
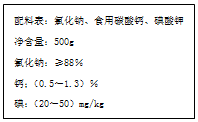
 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:分析 (1)钙以化合物形式存在,包装标签上钙含量是指钙元素;
(2)因为碳酸钙中含有碳酸根离子,溶于水或酸反应生成气体,故检验该盐中是否含有碳酸钙,在家庭厨房里可选用的物质是醋或水;
(3)根据n=$\frac{V}{Vm}$计算二氧化碳的物质的量,再根据方程式2HCl+CaCO3=CaCl2+CO2↑+H2O,计算碳酸钙的物质的量,根据钙元素守恒,利用m=nM计算钙元素的质量,利用质量分数定义计算.
解答 解:(1)钙以化合物形式存在,包装标签上钙含量是指钙元素,
故答案为:元素;
(2)因为碳酸钙中含有碳酸根离子,溶于水或酸反应生成气体,故检验该盐中是否含有碳酸钙,在家庭厨房里可选用的物质是醋或水;
故答案为:醋或水;
(3)67.2mL(标准状况)二氧化碳的物质的量为$\frac{0.0672L}{22.4L/mol}$=0.003mol,根据方程式2HCl+CaCO3=CaCl2+CO2↑+H2O可知10g这种盐,碳酸钙的物质的量为0.003mol,根据钙元素守恒可知,10g这种盐钙元素的质量为0.003mol×40g/mol=0.12g,故钙元素的质量分数为:$\frac{0.12g}{10g}$×100%=1.2%,
答:Ca元素的质量分数为1.2%.
点评 本题考查质量分数的计算、根据方程式的计算等,比较基础,注意基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2S的物质的量之比为10:1 | |
| B. | 硝酸的物质的量浓度为1.2mol/L | |
| C. | Cu(OH)2沉淀质量为29.4g | |
| D. | Cu、CuS与硝酸反应后剩余HNO3为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
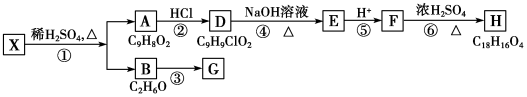
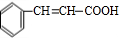 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.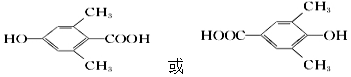 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO是氧化剂 | B. | CO是还原剂 | ||
| C. | CO既是氧化剂又是还原剂 | D. | CO既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/LNaOH溶液 | pH=11NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的PH>5 | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 等体积等PH的④溶液和盐酸分别与足量的Zn反应,④溶液生成同条件下氢气体积多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
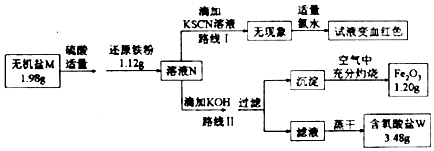
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将C2H4和SO2的混合气体通入足量酸性KmnO4试液中 | 得到纯净的C2H4 |
| B | 向5mL 0.1mol•L-1AgNO3溶液中加1mL0.1mol•L-1NH3•H2O | 制备银氨溶液 |
| C | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 | 制备纯净的FeCl2溶液 |
| D | 向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤 | 制备NaHCO3固体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com