
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.082 |
| 0.022×0.02 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.082 |
| 0.022×0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省宜宾市高三第一次诊断性测试化学试卷(解析版) 题型:填空题
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
(2)下列关于反应2SO2(g)+O2(g)
 2SO3(g)
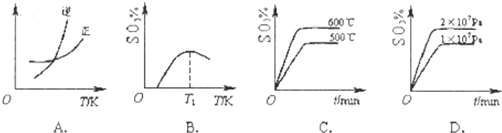
ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。

(3)某温度下SO2(g)+ 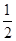 O2(g)
O2(g)
 SO3(g)
ΔH=-98KJ/mol
SO3(g)
ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com