
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
分析 ①硅燃烧生成二氧化硅,二氧化硅不溶于水不能直接生成硅酸;
②硫单质点燃反应生成二氧化硫,不能一步生成三氧化硫;
③碳高温和二氧化硅反应生成一氧化碳,二氧化碳通入氢氧化钠溶液生成碳酸钠和水;
④钠加热和氧气反应生成过氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
解答 解:①硅燃烧生成二氧化硅,Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2,二氧化硅不溶于水不能直接生成硅酸,给定条件下不能实现,故①符合;
②硫单质点燃反应生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,不能一步生成三氧化硫,给定条件下不能实现,故②符合;
③碳高温和二氧化硅反应生成一氧化碳,2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,不生成二氧化碳,给定条件下不能实现,故③符合;
④钠加热和氧气反应生成过氧化钠,2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2,给定条件下能实现,故④不符合;
故选C.
点评 本题考查了硅、硫、碳、钠及其化合物性质,主要是反应条件和反应产物的分析判断,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2(aq)$\stackrel{Cl_{2}}{→}$FeCl3(aq)$\stackrel{Cu}{→}$FeCl2(aq) | B. | H2SO3$\stackrel{△}{→}$Si02$\stackrel{HCl}{→}$SiCl4 | ||
| C. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHC03(s)$\stackrel{△}{→}$Na2CO3(s) | D. | CuS04 $\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
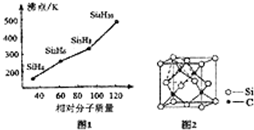
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
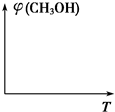 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
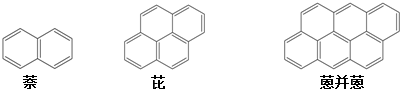
| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫 | |
| C. | 用氯化铵溶液除去铁锈 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com