
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 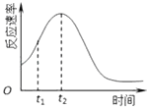
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
【答案】
(1)2;50;10
(2)5H2C2O4+2MnO4﹣+6H+=10CO2+2Mn2++8H2O
(3)其他条件相同时,溶液的初始pH越小,该反应的反应速率越快
(4)该反应放热;产物Mn2+是反应的催化剂
(5)滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;托盘天平、250mL容量瓶、酸式滴定管;![]()
【解析】解:(1)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为50mL,总体积为100mL,则C=50,D=50,B=20,E=10,探究外界条件对反应速率的影响,需保证其他条件相同,则①与②的pH不同,②与③的草酸浓度不同,
则A=2,
故答案为:2;50;10;(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水,其反应的离子方程式为:5H2C2O4+2MnO4﹣+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4﹣+6H+=10CO2↑+2Mn2++8H2O;(3)实验①和②只有pH不同,其它条件都相同,而且t1<t2 , 说明其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
故答案为:其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;(4)对于该反应,影响化学反应的速率只有温度和催化剂,所以反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:反应放热,温度升高或产物Mn2+是反应的催化剂;
故答案为:该反应放热;产物Mn2+是反应的催化剂;(5)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
称量固体用托盘天平、配制250ml溶液用250mL容量瓶、量取KMnO4溶液和草酸溶液用到酸式滴定管;
c(草酸)= ![]() =
= ![]() mol/L
mol/L
由关系式
2KMnO4 | ~ | 5H2C2O4 |
2 | 5 | |
cmolL﹣1×V×10﹣3L |
|
c= ![]() mol/L=
mol/L= ![]() mol/L,
mol/L,
故答案为:加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;托盘天平、250mL容量瓶、(酸式)滴定管; ![]() ;
;
(1)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,所以KMnO4的浓度不变,探究外界条件对反应速率的影响,需保证其他条件相同时来实验;(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水;(3)实验①和②只有pH不同,其它条件都相同;(4)根据外界条件对化学反应速率的影响;(5)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
根据称量固体用天平、配制溶液用容量瓶、量取液体用滴定管分析;
先求出醋酸的浓度,再由关系式2KMnO4~5H2C2O4计算.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室常用锌与2mol·L-1盐酸溶液制取氢气。下列措施会降低H2产生速率的是
A. 用锌粉代替锌块
B. 向该盐酸溶液中加入少量的氯化钠固体(忽略溶液体积变化)
C. 改用4mol·L-1盐酸溶液
D. 向该盐酸溶液中加入等体积、等浓度的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两相同容器内均进行如下反应:CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1 下列说法正确的是( ) 
A.由图象可知,B容器内反应速率较快
B.前2min内,v(CO)=0.15mol/(Lmin)
C.若容器的体积为10L,则3min内,B容器中反应放出热量43kJ
D.将A,B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
A.对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp= ![]()
B.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2 , 则平衡正向移动
C.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第4周期ⅥA族元素,下列叙述不正确的是( )
A. 硒是一种金属性很强的元素 B. 硒可以形成SeO2和SeO3
C. 硒的氢化物化学式为H2Se D. 硒的最高价氧化物对应水化物的化学式是H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中电离的方程式:
HNO3_______________________________;HClO___________________________________;
NaHCO3__________________________________、___________________________________。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是________________________________________________。
②H2的燃烧热为_____________________,C的燃烧热为____________________________。
③燃烧l0gH2 生成液态水,放出的热量为________________________________________。
④CO的燃烧热为___________,其热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为 , 质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣;加入酚酞呈红色的溶液:SO42﹣、K+、Cl﹣、HSO3﹣分别都不能大量共存(常温下)
B.![]() =1×10﹣12的溶液:K+、AlO2﹣、CO32﹣、Na+; pH=2的溶液:NO3﹣、Fe2+、Na+、Al3+分别都可以大量共存(常温下)
=1×10﹣12的溶液:K+、AlO2﹣、CO32﹣、Na+; pH=2的溶液:NO3﹣、Fe2+、Na+、Al3+分别都可以大量共存(常温下)
C.已知:25℃时,Mg(OH)2的Ksp=5.61×10﹣12 , MgF2的KSP=7.42×10﹣11 , 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2
D.表示H2燃烧热的化学方程式为:H2(g)+ ![]() O2(g)═H2O(1);△H=﹣285.8kJ/mol
O2(g)═H2O(1);△H=﹣285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com