
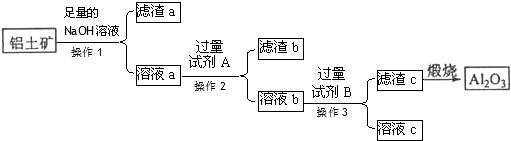
分析 铝土矿中Al2O3、SiO2和NaOH反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,Fe2O3和NaOH不反应,分离难溶性固体和溶液采用过滤方法,所以操作1是过滤,滤液a中含有NaOH、NaAlO2、Na2SiO3,滤渣a为Fe2O3;
如果A是盐酸,向滤液a中加入过量试剂A,然后过滤得到滤渣b和溶液b,加入的物质能和NaAlO2、Na2SiO3反应生成可溶性物质和难溶性物质,NaAlO2和过量稀盐酸反应生成可溶性的AlCl3,Na2SiO3和稀盐酸反应生成难溶性的H2SiO3,反应方程式分别为NaAlO2+4HCl=AlCl3+NaCl+2H2O、Na2SiO3+2HCl=H2SiO3↓+2NaCl,
同时还发生反应HCl+NaOH=NaCl+H2O,则滤液b中含有NaCl、AlCl3
,滤渣b为H2SiO3;
向滤液b中加入过量B,操作3为过滤,得到滤渣c和滤液c,滤渣煅烧生成氧化铝,则滤渣c为Al(OH)3,如果B为氨水,滤液c中含有NaCl和NH4Cl;
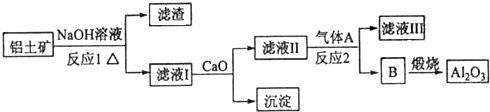
(4)铝土矿中Al2O3、SiO2和NaOH反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,Fe2O3和NaOH不反应,滤液I中含有NaOH、NaAlO2、Na2SiO3,滤渣为Fe2O3;
向滤液I中加入CaO,发生反应CaO+H2O=Ca(OH)2,Ca(OH)2和Na2SiO3发生复分解反应生成沉淀,反应方程式为Ca(OH)2+Na2SiO3=2NaOH+CaSiO3↓,然后过滤,则得到的沉淀是CaSiO3,滤液II中含有NaOH、NaAlO2,向滤液II中通入气体A,A反应生成沉淀B,B煅烧生成氧化铝,则B为Al(OH)3,A和偏铝酸钠反应生成氢氧化铝,则A为CO2,滤液A中含有碳酸钠或碳酸氢钠,
据此分析解答.
解答 解:铝土矿中Al2O3、SiO2和NaOH反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,Fe2O3和NaOH不反应,分离难溶性固体和溶液采用过滤方法,所以操作1是过滤,滤液a中含有NaOH、NaAlO2、Na2SiO3,滤渣a为Fe2O3;
如果A是盐酸,向滤液a中加入过量试剂A,然后过滤得到滤渣b和溶液b,加入的物质能和NaAlO2、Na2SiO3反应生成可溶性物质和难溶性物质,NaAlO2和过量稀盐酸反应生成可溶性的AlCl3,Na2SiO3和稀盐酸反应生成难溶性的H2SiO3,反应方程式分别为NaAlO2+4HCl=AlCl3+NaCl+2H2O、Na2SiO3+2HCl=H2SiO3↓+2NaCl,
同时还发生反应HCl+NaOH=NaCl+H2O,则滤液b中含有NaCl、AlCl3
,滤渣b为H2SiO3;
向滤液b中加入过量B,操作3为过滤,得到滤渣c和滤液c,滤渣煅烧生成氧化铝,则滤渣c为Al(OH)3,如果B为氨水,滤液c中含有NaCl和NH4Cl;
(1)通过以上分析知,操作1的名称是过滤,所需要的主要玻璃仪器除了漏斗、烧杯外还有玻璃棒
故答案为:过滤;玻璃棒;
(2)若试剂A是稀盐酸,滤渣b的主要成分是H2SiO3,故答案为:H2SiO3;
(3)若试剂B是氨水,写出溶液b加入过量试剂B所发生的有关反应离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)铝土矿中Al2O3、SiO2和NaOH反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,Fe2O3和NaOH不反应,滤液I中含有NaOH、NaAlO2、Na2SiO3,滤渣为Fe2O3;
向滤液I中加入CaO,发生反应CaO+H2O=Ca(OH)2,Ca(OH)2和Na2SiO3发生复分解反应生成沉淀,反应方程式为Ca(OH)2+Na2SiO3=2NaOH+CaSiO3↓,然后过滤,则得到的沉淀是CaSiO3,滤液II中含有NaOH、NaAlO2,向滤液II中通入气体A,A反应生成沉淀B,B煅烧生成氧化铝,则B为Al(OH)3,A和偏铝酸钠反应生成氢氧化铝,则A为CO2,滤液A中含有碳酸钠或碳酸氢钠,
滤液Ⅰ中加入CaO生成的沉淀是CaSiO3,气体A为CO2,
故答案为:CaSiO3;CO2;
(5)电解熔融的氧化铝可制备金属铝:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,若在标准状况下生成4.48L的氧气,n(O2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,根据氧气和转移电子之间的关系式得则该反应转移的电子数=0.2mol×4×NA/mol=4.816×1023或0.8NA,故答案为:4.816×1023或0.8NA.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析判断及知识综合运用能力,明确基本操作方法、元素化合物性质及反应原理是解本题关键,会根据物质之间的转化确定物质成分,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
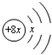 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com