
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
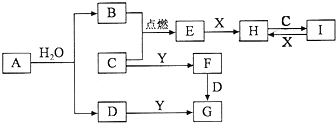 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
 在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白:
在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
 b.
b. c.
c.
 b.
b. c.
c.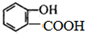
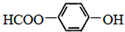
 的名称为
的名称为 核磁共振氢谱有
核磁共振氢谱有 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电解饱和食盐水 2Cl-+2H+
| ||||
| B、足量二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | ||||
| C、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | ||||
| D、碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com