
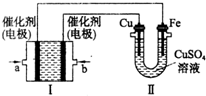
 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.分析 图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH变小;装置Ⅱ是电镀阳极电极反应可知,铜离子浓度不变;
③依据原电池和电解池中电子守恒计算消耗甲烷的体积.
解答 解:图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极.
①b处是氧气得到电子发生的电极反应;电极反应为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH变小;装置Ⅱ是电镀阳极电极反应可知,阳极电极反应为:Cu-2e-=Cu2+,阴极电极反应为:Cu2++2e-=Cu,铜离子浓度不变,
故答案为:变小,不变;
③装置Ⅱ中阴极电极反应为Cu2++2e-=Cu,质量增加12.8g为铜物质的量为0.2mol,转移电子为0.4mol,装置I中负极电极反应为:CH4+10OH--8e-=CO32-+7H2O理论上消耗甲烷物质的量为:0.05mol,标准状况下的体积为0.05mol×22.4L/mol=1.12L,
故答案为:1.12.
点评 本题考查了原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
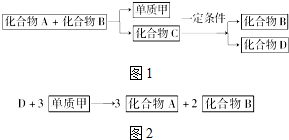 A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: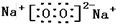 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作及现象 | 溶 液 |
| A | 通入CO2,溶液变浑浊.再升温至65℃以上,溶液变澄清 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加热溶液,又变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
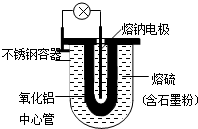 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com