
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,单原子分子中不存在化学键,据此分析解答.
解答 解:这几种物质中Ne是单原子分子,不含化学键;水分子中O-H原子之间中存在共价键,为共价化合物;HCl中H-Cl原子之间存在共价键,为共价化合物;KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物;过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,为离子化合物;
既存在共价键又存在离子键的是④⑤,不存在化学键的是①,属于共价化合物的是②③,③的物质溶于水时破坏分子间作用力,
故答案为:④⑤;①;②③;分子间作用力.
点评 本题考查化学键,为高频考点,明确离子键和共价键区别是解本题关键,侧重考查学生分析判断能力,注意:并不是所有物质中都存在化学键,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.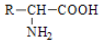 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com