
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
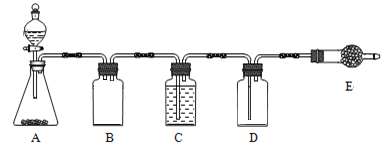
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
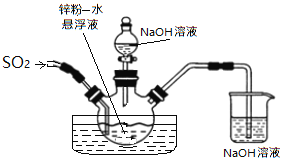
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
【答案】 分液漏斗 Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O 防倒吸影响制气 干燥气体 碱石灰 SO2 2 Na+ 较小 2HCOO- + 4SO2 + CO32- = 2S2O42- + H2O + 3CO2(HCOO-+2SO2+CO32-+H+=S2O42-+2CO2+H2O) 87%
【解析】 (1). ①A中盛浓硫酸的玻璃仪器为分液漏斗。实验室中制备SO2主要采用以下反应Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O;
②B装置为安全瓶,可防倒吸影响制气,C装置的作用是干燥气体,利用浓硫酸的吸水性,且不与SO2气体反应;
③E的作用是收集尾气,防止SO2气体逸出到空气中,试剂为碱石灰;
(2)①反应后仅SO2中S元素的化合价降低,所以SO2为氧化剂;生成1mol Na2S2O4需要
1mol ZnS2O4,需要氧化1mol金属Zn,转移电子2mol。
②溶液中加入氯化钠使Na+离子浓度增大,使得Qc(Na2S2O4)增大,促进Na2S2O4结晶析出;Na2S2O4在酒精中的溶解度较小,酒精吸水后容易与Na2S2O4结晶分离;
③甲醇为溶剂,不参与反应,甲酸根、碳酸根、二氧化硫、氢离子为反应物,生成S2O42-、CO2和水,配平反应离子方程式: HCOO-+ CO32-+ 2SO2+H+= S2O42-+CO2+H2O。
(3)消耗KMnO4溶液的物质的量为18×0.1×0.001mol=0.0018mol,氧化Na2S2O4为0.0015mol,则样品中Na2S2O4的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
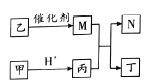
A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素和硼族元素在生产生活中有很重要的地位。
(1)写出硼族元素Ga的基态原子核外电子排布式_________________。
(2)NF3的分子构型为__________,NO3-的空间构型为______,1molNO3-中含有的σ键的数目为:_________。
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式________。
(4)元素第一电离能的大小:As______(填“”或“=”)Ga,原因是__________。
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是__________。
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为________,晶胞中As原子和它最近的Ga原子之间的距离为_______pm(用含c的式子表示),砷化镓的密度为_______g/cm3(设NA为阿伏加德罗常数的值,用含c、NA的式子表示,原子量:Ga-70,As-75)。
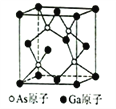
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧热是指1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。已知下列热化学方程式:
![]() CH4(g)+O2(g)===
CH4(g)+O2(g)===![]() CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CH4(g)+![]() O2(g)===CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
O2(g)===CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
则CH4的燃烧热为( )
A. 445.15 kJ·mol-1 B. 607.3 kJ·mol-1
C. 890.3 kJ·mol-1 D. 802.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。
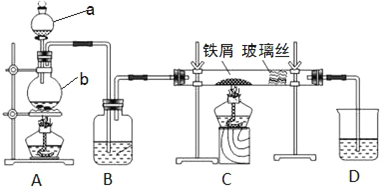
(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.00L 1.00molL﹣1H2SO4溶液与2.00L 1.00molL﹣1 NaOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H为_____,表示其中和热的热化学方程式为_____.
(2)在25℃、101KPa时,1.00g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,C6H6的燃烧热为_____KJmol﹣1,该反应的热化学方程式为_____.
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
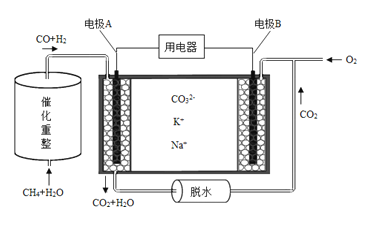
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。(已知:Na2SO3+H2SO4===Na2SO4+SO2↑+
H2O)
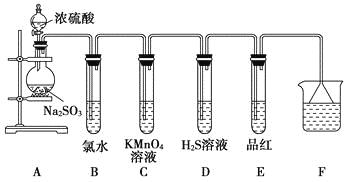
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。
(2)反应后,装置B中发生的现象是_________________________________;反应的离子方程式为______________________________;装置C中的现象是___________________________,表现了SO2的________;装置D中现象是_____________________________________________,发生反应的化学方程式为_________________________________________。
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________________。
(4)F装置的作用是________________________,漏斗的作用是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com