
| A. | SO3溶解于水时能导电,所以SO3是电解质 | |
| B. | 离子化合物中不存在独立的分子 | |
| C. | 稀硝酸能导电,所以HNO3溶液属于电解质 | |
| D. | 熔融时能导电的物质一定是电解质 |
分析 A.三氧化硫的水溶液能导电,但三氧化硫是非电解质;
B.离子化合物有阴阳离子构成的;
C.电解质和非电解质都必须是化合物;
D.在水溶液或是熔融态能导电的化合物是电解质;
解答 解:A.SO3溶于水后和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,电离出阴阳离子的物质是硫酸而不是三氧化硫,所以SO3是非电解质,故A错误;
B.离子化合物有阴阳离子构成的,不存在独立的分子,故B正确;
C.电解质和非电解质都必须是化合物,HNO3溶液属于混合物,所以即不是电解质也不是非电解质,故C错误;
D.在水溶液或是熔融态能导电的化合物是电解质,电解质必须是化合物的范畴,例如熔融的金属单质也导电,但金属单质不属于化合物,故D错误;
故选:B.
点评 本题考查电解质的判断以及离子晶体的构成微粒,根据定义来分析解答即可,注意电解质和非电解质都必须是化合物,为易错点.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
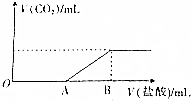 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
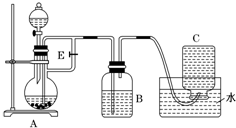 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol•L-1硫酸溶液,其他试剂任选.填写下列空白:
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol•L-1硫酸溶液,其他试剂任选.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
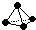 ,已知断裂1mol B-B吸收167kJ的热量,生成1mol B≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:N4(g)═2N2(g)△H=-882 kJ/mol;
,已知断裂1mol B-B吸收167kJ的热量,生成1mol B≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:N4(g)═2N2(g)△H=-882 kJ/mol;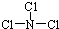 ,X与水反应的化学方程式是NCl3+3H2O═NH3+3HClO;
,X与水反应的化学方程式是NCl3+3H2O═NH3+3HClO;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com