
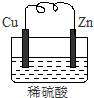
 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.分析 (1)原电池中较活泼金属做负极,发生失电子的氧化反应;
(2)原电池正极上,是电解质中的阳离子得电子的过程;
(3)根据电极反应来确定气体的量和转移电子之间的关系,计算金属质量减轻质.
解答 解:(1)Zn、Cu、硫酸构成的原电池中,金属锌做负极,发生失电子的氧化反应,
故答案为:锌;氧化;
(2)Zn、Cu、硫酸构成的原电池中,正极上是电解质中的氢离子得电子的过程,电极反应式为:2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
(3)根据电极反应:2H++2e-═H2↑,当产生3.36L(标准状况)即0.15mol的气体时,转移电子为0.3mol,负极上减少的是金属锌,根据负极电极反应:Zn-2e-=Zn2+,转移0.3mol电子,负极质量减少0.15mol,质量是0.15mol×65g/mol=9.75g.
故答案为:0.3;9.75.
点评 本题考查了原电池原理,明确原电池的判断方法、正负极的判断、正负极上发生的反应即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe与足量盐酸反应,反应中转移的电子数为0.3NA | |
| B. | 0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 | |
| C. | 常温下,28 g的N2和CO混合气体含有的原子数为2NA | |
| D. | 1mol Na2O2和足量CO2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热 | |
| B. | 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差 | |
| D. | 萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
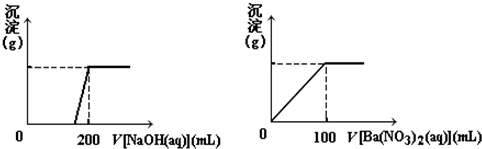
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和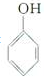 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com