
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.分析 (1)电解硫酸铜溶液,如果阳极上析出氧气,则阳极是惰性电极,工作时,阳极上氢氧根离子放电,阴极上铜离子放电,则阳极连接电源正极,阴极连接电源负极;
(2)电解硫酸铜溶液,根据阴阳极上离子放电顺序书写电池反应式及溶液中出现的现象;
(3)要测定铜的相对原子质量还要测定析出铜的质量;
(4)测定铜的质量,要测定电解前后电极的质量,测定电极质量时要除去电极上吸附的离子的干扰;
(5)根据铜的相对原子质量和氧气的关系式计算;
(6)甲醇燃料碱性电池中,负极上失电子发生氧化反应.
解答 解:(1)若实验中测定在标准状况下放出的氧气的体积VL,说明阳极上是氢氧根离子放电而不是铜放电,所以铜作阴极,石墨作阳极,则A连接直流电源的负极,B连接正极,
故答案为:正极;
(2)电解硫酸铜时,石墨作阳极,则阴极上铜离子得电子而析出铜,阳极上氢氧根离子放电而生成氧气,溶液中铜离子浓度减小,溶液颜色变浅,电池反应式为:2Cu2++2H2O$\frac{\underline{\;高温\;}}{\;}$2Cu+O2↑+4H+,
故答案为:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O$\frac{\underline{\;高温\;}}{\;}$2Cu+O2↑+4H+;
(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选②;
(4)A.称量电解前电极的质量和电解后的质量,从而得出析出铜的质量,故A正确;
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗,除去吸附的离子,故B错误;
C.根据电解前后电极的质量差来计算即可,不用刮下电解过程中电极上析出的铜,故C错误;
D.为防止铜和氧气反应,所以在有空气存在的情况下,烘干电极必须采用低温烘干的方法,故D正确;
故答案为:AD;
(5)根据2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=$\frac{22.4m}{2V}$=$\frac{11.2m}{V}$,
故答案为:$\frac{11.2m}{V}$;
(6)甲醇燃料碱性电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查电解实验,为高频考点,难点是电极反应式的书写,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,如果燃料和氧化剂相同,而电解质溶液不同,则电极反应式也不同,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 油脂发生皂化反应能生成甘油 | |
| D. | 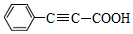 是高分子化合物 是高分子化合物 的单体 的单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
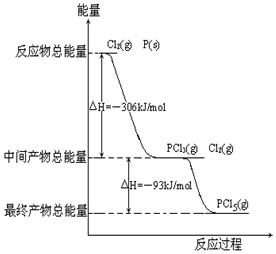 Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com