
分析 (1)①Na2[Fe(CN)5(NO)]中中心离子为Fe3+,价电子构型为3d5,5个电子分散在5个d轨道上,能量较低;
②Na2[Fe(CN)5(NO)]中原子序数之和为15的两种元素分别为N和O,其中第一电离能较大的为N;二者形成常见的原子个数比为1:3的微粒,为$N{O}_{3}^{-}$;
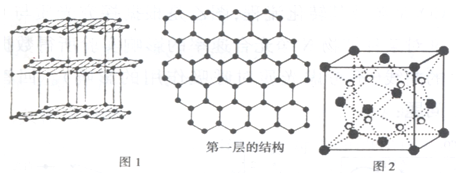
(2)12g石墨单质为1mol,1mol石墨单质含有NA个C原子,石墨单质中,一个C原子为三个六元环共用,一个六元环含有的C原子数应为$6×\frac{1}{3}=2$;
(3)根据晶胞密度的计算公式$ρ=\frac{z{M}_{r}}{{N}_{A}•V}$计算可得,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积.
解答 解:(1)①Na2[Fe(CN)5(NO)]中中心离子为Fe3+,价电子构型为3d5,5个电子分散在5个d轨道上,能量较低,因此含有的未成对电子数为5.故答案为:5;
②Na2[Fe(CN)5(NO)]中原子序数之和为15的两种元素分别为N和O,其中第一电离能较大的为N;二者形成常见的原子个数比为1:3的微粒,为$N{O}_{3}^{-}$,根据VSEPR理论,$N{O}_{3}^{-}$中成键原子数为BP=3,孤对电子数为$LP=\frac{5-2×3+1}{2}=0$,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,为sp2杂化,离子构型为平面三角形.
故答案为:氮;平面三角形;
(2)12g石墨单质为1mol,1mol石墨单质含有NA个C原子,石墨单质中,一个C原子为三个六元环共用,一个六元环含有的C原子数应为$6×\frac{1}{3}=2$,因此1mol石墨单质中,含有的六元环数为$\frac{{N}_{A}}{2}$,已知一个六元环的面积为${S}_{0}=5.24×1{0}^{-20}{m}^{2}$,则12g石墨单质,若把每一层都取下,平铺在一起,整个面积实际上只需计算所有六元环的面积之和,应为$S=\frac{{N}_{A}}{2}{S}_{0}$=$\frac{6.02×1{0}^{23}×5.24×1{0}^{-20}}{2}=1.58×1{0}^{4}{m}^{2}$.
故答案为:1.58×104;
(3)由Na2O的晶胞,晶胞中,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,内部粒子为整个晶胞所有,黑色的粒子数为$8×\frac{1}{8}+6×\frac{1}{2}=4$,白色粒子数为8,显然,白色粒子为Na+,黑色粒子为O2-,取1mol晶胞,则含有NA个晶胞,1mol晶胞有12mol粒子,一个晶胞的质量为m=8mol×23g/mol+4mol×16g/mol=248g,一个晶胞的体积为${V}_{0}={a}^{3}$,则晶胞的密度为$ρ=\frac{m}{{N}_{A}•{V}_{0}}$=$\frac{248g}{{N}_{A}•{a}^{3}c{m}^{3}}=\frac{248}{{N}_{A}{a}^{3}}g/c{m}^{3}$,则晶胞的边长为$a=\root{3}{\frac{248}{ρ{N}_{A}}}$,
故答案为:$\root{3}{\frac{248}{ρ{N}_{A}}}$.
点评 本题考查过渡金属核外电子的排布,第一电离能,价层电子对互斥理论,杂化轨道理论判断粒子构型,晶胞的计算,题目较综合,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有x+2 | B. | 可能是x+2 或x+10或x+24 | ||
| C. | 可能是x+24 | D. | 可能是x+2或x+12或x+26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20 g D2O分子中所含中子数为10 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通入水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 常温常压下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
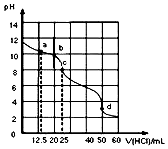 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 向该装置中加入金属Zn和稀硫酸,并关闭活塞,用于检查装置的气密性 | 用该装置制备少量白色的Fe (OH)2沉淀 | 灼烧CuSO4使其分解 | 分离葡萄糖和蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别蚕丝与人造纤维:分别取少许点燃,闻气味 | |
| B. | 提纯含少量苯酚的苯:向含少量苯酚的苯溶液中加入浓溴水,静置、过滤 | |
| C. | 验证NH4+水解是吸热反应:向0.1mol•L-1NH4Cl溶液中插入温度计,微热溶液,观察读数 | |
| D. | 检验C4H9X中的卤素:向少量C4H9X中加入NaOH溶液煮沸一会,冷却后直接加入AgNO3溶液,观察现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com