
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
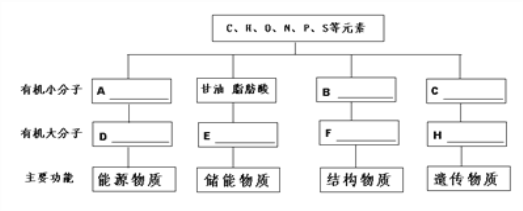
(1)A一般是指_____________;D在动物细胞中是指__________。
(2)E 是指_____________,它还有___________________的功能。
(3)B是指____________,其结构通式是______________,B形成[F]_________ 的过程叫____________。
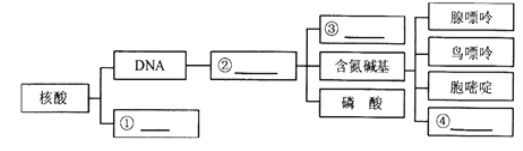
(4)如图中,是指______________,②是指______________,其中③是指___________
【答案】葡萄糖 糖原 脂肪 保温、缓冲、减压 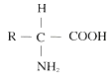 氨基酸 蛋白质 脱水缩合 RNA 脱氧核苷酸 脱氧核糖
氨基酸 蛋白质 脱水缩合 RNA 脱氧核苷酸 脱氧核糖
【解析】
梳理细胞中生物大分子的化学组成及其功能,形成知识网络。在此基础上,从图示中提取有效信息,准确定位图中各字母或数字所指代的物质名称,进而对相关问题情景进行解答。根据题上图中有机大分子的归纳可知,D、E、F、H分别是多糖、脂肪、蛋白质、核酸,构成它们基本单位A、B、C依次是葡萄糖、氨基酸、核苷酸。题下图中核酸分为DNA和RNA,其中DNA的基本单位是脱氧核苷酸;一分子的脱氧核苷酸是由一分子的脱氧核糖、一分子的含氮碱基、一分子的磷酸组成,组成DNA的含氮碱基包括腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。
(1)糖类是主要的能源物质,据此分析图示可知:A一般是指葡萄糖,D是多糖,动物细胞中的多糖是糖原。
(2)脂肪是细胞内良好的储能物质,因此储能物质E是脂肪,在动物体中的脂肪还具有保温作用和保护内脏器官,缓冲、减压的作用。
(3)许多蛋白质是组成细胞和生物体结构的重要物质,据此可判断结构物质F是蛋白质,其基本组成单位B是氨基酸,氨基酸的结构通式是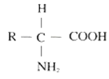 。氨基酸形成蛋白质的过程叫脱水缩合。
。氨基酸形成蛋白质的过程叫脱水缩合。
(4)核酸包括DNA和RNA,DNA的基本单位是脱氧核苷酸;一分子的脱氧核苷酸是由一分子的脱氧核糖、一分子的含氮碱基、一分子的磷酸组成,组成DNA的含氮碱基包括腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。综上所述并结合图示分析可推知,①是RNA,②是指脱氧核苷酸,③是指脱氧核糖,④是指胞嘧啶。


科目:高中化学 来源: 题型:
【题目】环保、安全的铝空气电池的工作原理如图所示,下列有关叙述错误的是( )
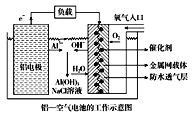
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把纯净的甲烷与氯气混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法中,不正确的是
A.气体发生爆炸反应B.瓶内气体的颜色变浅
C.用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生D.集气瓶壁有油状液体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物的结构分析回答:
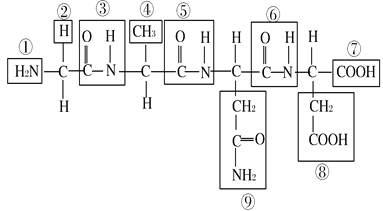
(1) 该化合物中,①表示 ,⑦表示 。
(2) 该化合物由 个氨基酸失去 个水分子而形成,这种反应叫做 。
(3) 该化合物中的氨基酸种类不同,是由 决定的,其编号是 。
(4) 该化合物称为 ,含 个肽键,编号是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域。
(1)在三个1L的恒容密闭容器中,分別加入0.10molN2和0.30molH2发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
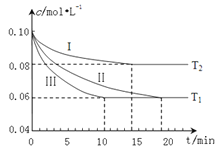
①与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件为_________、_________。
②实验Ⅲ在0~10 min的平均反应速率v(H2)=_________。
(2)分别以N2、H2为电极反应物,HCl-NH4Cl为电解质溶液制造新型燃料电池,试写出该电池正极的电极反应式:______________________。
(3)常温下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_________。
(4)工业上用NH3消除NO、NO2 污染。当n(NO)∶n(NO2) =1∶1时,在高温及催化剂条件下,每生成1mol N2放出热量akJ,请书写该反应的热化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 甲醇、乙二醇、丙三醇都易溶于水且都有毒
B. 含有羟基的化合物属于醇类
C. 苯酚呈弱酸性,不能使石蕊试液显浅红色
D. 酚类和醇类具有相同的官能团, 因而具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
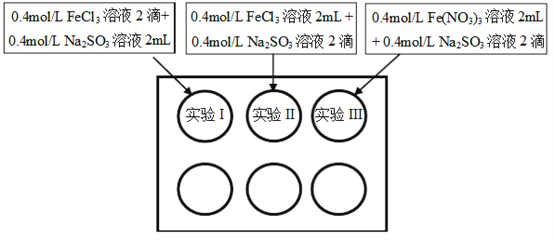
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=== ![]() +2H2O
+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com