
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
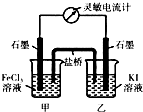
分析 (1)KSCN溶液是检验Fe3+的试剂,通过三价铁离子是否剩余来判断KI溶液和FeCl3溶液反应的限度;加入四氯化碳的作用是 萃取碘单质,排除对后续实验颜色观察的干扰;
(2)根据实验记录分析,加入氯化铁的量过少,导致铁离子浓度过小; 用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小;
(3)①反应达到平衡时,正逆反应速率相等,没有电子发生转移,即:电流计读数为零;
②反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+.
解答 解:(1)可以用KSCN溶液,来检验三价铁是否剩余,若果溶液显红色,说明三价铁剩余,KI溶液和FeCl3溶液反应不彻底,反之则进行彻底;因为碘水有颜色,加入四氯化碳的作用是 萃取碘单质,排除对后续实验颜色观察的干扰,
故答案为:上层溶液呈血红色;萃取碘单质,排除对后续实验颜色观察的干扰;
(2)根据实验记录分析,导致Fe3+浓度过低的原因是加入氯化铁的量过少,导致铁离子浓度过小;乙同学结合平衡移动的知识,认为还有一个原因是 用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小,
故答案为:加入氯化铁的量过少,导致铁离子浓度过小;用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小;
(3)①a、当电流计为零时,说明没有电子发生转移,则反应达到平衡,故a正确;
b.电流计指针不再偏转且不为零,说明反应匀速进行,未达平衡,故b错误;
c.电流计指针偏转角度最大,说明反应正在进行,未达平衡,速率达最大值,故c错误;
d.甲烧杯中溶液颜色不再改变,说明各物质浓度不在改变,已达平衡,故d正确;
故答案为:ad;
②反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+,发生反应:2Fe2+-2e-=2Fe3+,甲为负极,
故答案为:甲;2Fe2+-2e-=2Fe3+.
点评 本题性质实验方案的设计,为高考常见题型和考点,题目难度中等,涉及原电池工作原理、化学平衡及其影响、性质实验方案的设计与评价等知识,试题侧重考查学生的分析、理解能力及化学实验能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
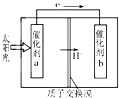 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )| A. | 该过程可以实现太阳能与电能的直接转换 | |
| B. | 催化剂a表面发生氧化反应,有O2产生 | |
| C. | 催化剂b附近酸性增强,催化剂a附近酸性减弱 | |
| D. | 催化剂a表面的反应是CO2+2H++2e-═HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
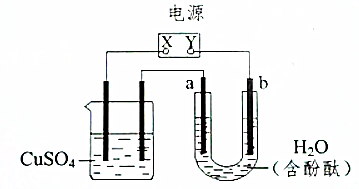 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H2O+2e-═H2↑+2OH- | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油与水互不相溶,可用裂化汽油萃取溴水中的溴 | |
| B. | 明矾能水解生成氢氧化铝胶体,可用作水的净化剂 | |
| C. | Na2CO3溶液具有碱性,可用热的浓Na2CO3溶液洗涤试管内壁的油污 | |
| D. | Mg(OH)2受热分解生成H2O和MgO且△H>0,可用Mg(OH)2作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
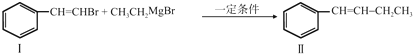
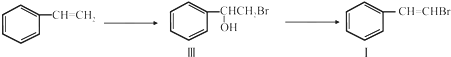
 .
.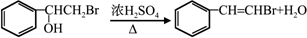 ;(注明反应条件)
;(注明反应条件)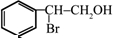 ,Ⅴ的结构简式为
,Ⅴ的结构简式为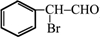 .
.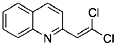 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 充电时阴极发生氧化反应 | |
| B. | 放电时负极的电极反应为CH3OH+8OH--6e-═CO32-+6H2O | |
| C. | 通入0.25mol氧气并完全反应后,有1mol电子转移 | |
| D. | 放电时阴离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com