
| A. | 硅胶可作袋装食品的干燥剂 | B. | 84消毒液的有效成分是NaClO | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 氢氧化铝可作胃酸的中和剂 |
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.2 mol/L | C. | 0.25 mol/L | D. | 0.3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3溶解度较大 | B. | KHCO3溶解度较小 | C. | K2CO3溶解度较大 | D. | K2CO3溶解度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
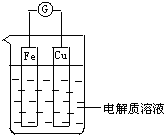 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com