
| A. | ①②⑥ | B. | ①③④⑥ | C. | ②③④⑥ | D. | ⑥ |
分析 ①Cu 和热浓硫酸反应生成SO2分子;
②求出5.6g铁粉的物质的量,然后根据铁与Cl2反应变为+3价来分析;
③溶液中Al3+会水解;
④2L 0.5mol/L硫酸钾溶液中的阴离子除了硫酸根,还有氢氧根;
⑤Na2O2固体由2个钠离子和1个过氧根构成;
⑥丙烯和环丙烷的最简式均为CH2.
解答 解:①Cu 和热浓硫酸反应生成SO2分子,不能生成三氧化硫,故错误;
②5.6g铁粉的物质的量为0.1mol,而铁与Cl2反应变为+3价,故0.1mo铁失去0.3NA个电子,故错误;
③溶液中Al3+会水解,故溶液中铝离子的个数小于0.1NA个,故错误;
④2L 0.5mol/L硫酸钾溶液中的阴离子除了硫酸根,还有氢氧根,故溶液中的阴离子所带的电荷数多于NA个,故错误;
⑤Na2O2固体由2个钠离子和1个过氧根构成,故1mol过氧化钠中含有的离子共为3NA个,故错误;
⑥丙烯和环丙烷的最简式均为CH2,故42g混合物中含有的CH2的物质的量为3mol,则含H原子个数为6NA个,故正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
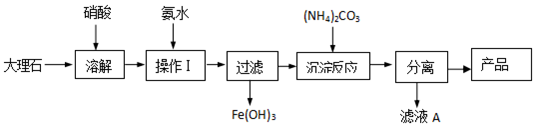
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 甲 | 乙 | 丙 |
| A | Al2O3 | HNO3 | NaOH |
| B | N2 | O2 | NH3 |
| C | SiO2 | KOH | HF |
| D | SO2 | Ba(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端与烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯不接触 | |
| D. | 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2)/mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A. | 反应在20 min内的平均速率为v(H2)=0.04 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于$\frac{1}{3}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com