
| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.041 | 0.270 | 0.012 |
·ÖĪö £Ø1£©¢ŁÓɱķÖŠŹż¾ŻæÉÖŖ£¬ÉżøßĪĀ¶Č£¬Ę½ŗā³£Źż¼õŠ”£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬æÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£ØĶ¬ÖÖĪļÖŹ£©»ņÕżÄę·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĻµŹżÖ®±Č£Ø²»Ķ¬ĪļÖŹ£©£¬Ę½ŗāŹ±ø÷ÖÖĪļÖŹµÄĪļÖŹµÄĮ攢ÅØ¶ČµČ²»ŌŁ·¢Éś±ä»Æ£¬ÓÉ“ĖŃÜÉśµÄŅ»Š©ĪļĄķĮæ²»±ä£»
¢Śøł¾ŻĘ½ŗāÅØ¶Č¼ĘĖć³öĘ½ŗā³£Źż£»
£Ø2£©Ę½ŗāŗóŃ¹ĖõČŻĘ÷Ģå»żÖĮŌĄ“µÄ$\frac{1}{2}$£¬Ń¹ĒæŌö“󣬷“Ó¦ĖŁĀŹŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ŅņĖŁĀŹ²»±ä£¬ŌņĘ½ŗā³£Źż²»±ä£®
½ā“š ½ā£ŗ£Ø1£©¢ŁÓɱķÖŠŹż¾ŻæÉÖŖ£¬ÉżøßĪĀ¶Č£¬Ę½ŗā³£Źż¼õŠ”£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌņÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬”÷H£¼0£¬
A£®·“Ó¦Ē°ŗóĢå»ż²»µČ£¬ŌņĢåĻµµÄŃ¹Ēæ²»±ä£¬æÉĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬¹ŹAÕżČ·£»
B£®·“ӦȯĘ÷Ģå»ż²»±ä£¬ĘųĢåÖŹĮæ²»±ä£¬ŌņĆÜ¶Č²»±ä²»ÄÜĖµĆ÷“ļµ½Ę½ŗā£¬¹ŹB“ķĪó£»
C£®·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»µČ£¬»ģŗĻĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæ²»±ä£¬æÉĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬¹ŹCÕżČ·£»
D£®c£ØCO£©=c£ØCH3OH£©£¬²»ÄÜĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬ŅņĘ½ŗā³£ŹżŅŌ¼°ĒāĘųµÄÅضČĪ“ÖŖ£¬¹ŹD“ķĪó£®
¹Ź“š°øĪŖ£ŗ£¼£»AC£»
¢ŚCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©µ„Ī»ĪŖmol/L
·“Ó¦æŖŹ¼ 1mol/L 3mol/L 0
·“Ó¦ 0.8mol/L 1.6mol/L 0.8mol/L
Ę½ŗā 0.2mol/L 1.4mol/L 0.8mol/L
Ę½ŗā³£ŹżK=$\frac{0.8}{0.2”Į1£®{4}^{2}}$=2.041£¬
¹Ź“š°øĪŖ£ŗ2.041£»
£Ø2£©a£®ŅņĪĀ¶Č²»±ä£¬ŌņĘ½ŗā³£ŹżK²»±ä£¬¹Źa“ķĪó£»
b£®Ōö“óŃ¹Ēæ£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“󣬹Źb“ķĪó£»
c£®Ę½ŗāÕżĻņŅĘ¶Æ£¬ŌņÖŲŠĀĘ½ŗāc£ØH2£©/c£ØH2O£©¼õŠ”£¬¹ŹcÕżČ·£®
¹Ź“š°øĪŖ£ŗc£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć¼°»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶Ļ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ¶Ō»ÆŃ§Ę½ŗāדĢ¬ĢŲÕ÷µÄĄķ½ā¼°»ÆŃ§Ę½ŗāÖŖŹ¶µÄĮé»īŌĖÓĆ£¬ĄūÓĆČż¶ĪŹ½·ÖĪö½ā“š£¬×¢Ņā£ŗ¼ĘĖć»ÆŃ§Ę½ŗā³£ŹżŹ±±ŲŠėÓĆĘ½ŗāŹ±ø÷ĪļÖŹÅØ¶Č£¬²»ŹĒČĪŅāŹ±æĢÅØ¶Č£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ö»ÓŠ¢Ł¢Ś | B£® | Ö»ÓŠ¢Ł¢Ś¢ÜÓŠ¾”ÓŠ | C£® | Ö»ÓŠ¢Ł¢Ś¢Ū | D£® | Č«²æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆ·ÖŅŗĀ©¶·½«¾Ę¾«ŗĶĖ®·ÖĄė | |
| B£® | ÓĆŃęÉ«·“Ó¦¼ų±šNa2SO4ŗĶNa2CO3 | |
| C£® | ÓĆNaOH ČÜŅŗ³żČ„Cl2ÖŠ»ģÓŠµÄÉŁĮæHCl | |
| D£® | ÓĆ×ĘÉÕ²¢ĪÅĘųĪ¶£¬Č·¶ØĻĖĪ¬ŹĒ·ńŹĒµ°°×ÖŹĻĖĪ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
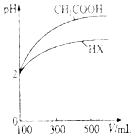 Ė®ŹĒÉśĆüµÄŌ“ČŖ£¬¹¤ŅµµÄŃŖŅŗ”¢³ĒŹŠµÄĆüĀö£¬ŅŖ±£»¤ŗĆŗÓĮ÷£¬ŗÓĖ®ŹĒÖŲŅŖµÄŅūÓĆĖ®Ō“£¬ĪŪČ¾ĪļĶعżÓĆĖ®Ö±½Ó¶¾ŗ¦ČĖĢ壬Ņ²æÉĶعżŹ³ĪļĮ“ŗĶ¹ąøČÅ©Ģļ¼ä½ÓĪ£¼°½”æµ£®ĒėĪŹ“šĻĀĮŠĪŹĢā£ŗ
Ė®ŹĒÉśĆüµÄŌ“ČŖ£¬¹¤ŅµµÄŃŖŅŗ”¢³ĒŹŠµÄĆüĀö£¬ŅŖ±£»¤ŗĆŗÓĮ÷£¬ŗÓĖ®ŹĒÖŲŅŖµÄŅūÓĆĖ®Ō“£¬ĪŪČ¾ĪļĶعżÓĆĖ®Ö±½Ó¶¾ŗ¦ČĖĢ壬Ņ²æÉĶعżŹ³ĪļĮ“ŗĶ¹ąøČÅ©Ģļ¼ä½ÓĪ£¼°½”æµ£®ĒėĪŹ“šĻĀĮŠĪŹĢā£ŗ| »ÆѧŹ½ | µēĄėĘ½ŗā³£Źż£Ø25”ę£© |
| HCN | K=4.9”Į10-10 |
| CH3COOH | K=1.8”Į10-5 |
| H2CO3 | K1=4.3x10-7£¬K2=5.6”Į10-11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū¢Ż¢Ž | B£® | ¢Ł¢Ś¢Ü¢Ž | C£® | ¢Ł¢Ū¢Ż¢ß | D£® | ¢Ł¢Ū¢Ż¢ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ”÷H4=$\frac{2}{3}$ £Ø3”÷H3-”÷H1£©-”÷H2 | B£® | ”÷H4=$\frac{2}{3}$ £Ø”÷H1+”÷H2£©+”÷H3 | ||
| C£® | ”÷H4=$\frac{2}{3}$ £Ø”÷H1+”÷H2£©-”÷H3 | D£® | ”÷H4=$\frac{2}{3}$ £Ø”÷H1-”÷H2£©-”÷H3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉżøßĪĀ¶Č£¬Ę½ŗā³£ŹżK±ä“ó | |
| B£® | Ōö“óŃ¹Ē棬W£Øg£©ĪļÖŹµÄĮæ·ÖŹż±ä“ó | |
| C£® | ÉżĪĀ£¬Čō»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±äŠ”£¬ŌņÕż·“Ó¦·ÅČČ | |
| D£® | Ōö“óXÅØ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com