
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
分析 A.铁具有还原性,不具有吸水性;
B.铝与浓硫酸发生钝化,生成致密的氧化膜;
C.硫酸铝与碳酸氢钠能制作泡沫灭火剂,相互促进水解;
D.HF为弱酸.
解答 解:A.铁具有还原性,不具有吸水性,则用含有铁粉的透气小袋与食品一起密封包装,可防止食品氧化,故A错误;
B.铝与浓硫酸发生钝化,生成致密的氧化膜,阻止Al继续反应,则浓硫酸可以盛放在铝桶中,故B错误;
C.硫酸铝与碳酸氢钠能制作泡沫灭火剂,相互促进水解生成大量的二氧化碳气体,可用于灭火,故C正确;
D.HF为弱酸,但能与玻璃中的二氧化硅反应,故D错误;
故选C.
点评 本题考查物质的性质,为高频考点,侧重于学生的分析、应用能力的考查,注意把握常见金属的化学性质、化学与生活的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.04 0.04 | B. | 0 0.04 | C. | 0.2 0.2 | D. | 0 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
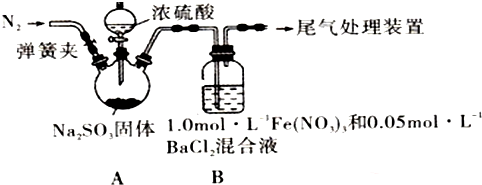
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.
二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
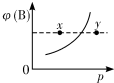 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点的混合物中v(正)<v(逆) | D. | x点比y点的正反应速率小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com