
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
【答案】D
【解析】A、两者不反应,根据溶液呈现电中性,c(NH4+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),因为pH=7, c(H+)=c(OH-),即c(NH4+)=c(HCO3-)+2c(CO32-),故错误;B、HSO3-
c(H+)=c(OH-),即c(NH4+)=c(HCO3-)+2c(CO32-),故错误;B、HSO3- H++SO32-,NH3和H+反应,生成亚硫酸钠和亚硫酸铵,水解的程度是微弱的,c(Na+)>c(SO32-)=c(NH4+),故错误;C、Na2SO3+SO2+H2O=2NaHSO3,pH=7,反应后溶液的溶质Na2SO3、NaHSO3,根据物料守恒:2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)],故错误;D、CH3COONa+HCl=CH3COOH+NaCl,溶液pH=7,反应后的溶质:NaCl、CH3COOH、CH3COONa,电离和水解相等,即:c(Na+)>c(CH3COOH)=c(Cl-),故正确。
H++SO32-,NH3和H+反应,生成亚硫酸钠和亚硫酸铵,水解的程度是微弱的,c(Na+)>c(SO32-)=c(NH4+),故错误;C、Na2SO3+SO2+H2O=2NaHSO3,pH=7,反应后溶液的溶质Na2SO3、NaHSO3,根据物料守恒:2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)],故错误;D、CH3COONa+HCl=CH3COOH+NaCl,溶液pH=7,反应后的溶质:NaCl、CH3COOH、CH3COONa,电离和水解相等,即:c(Na+)>c(CH3COOH)=c(Cl-),故正确。
【考点定位】考查离子浓度大小比较中电荷守恒、物料守恒等知识。
【名师点睛】涉及离子浓度大小比较,常用规律:电荷守恒、质子守恒、物料守恒、水解程度和弱电解质电离程度微弱,然后分析反应后溶液中溶质有哪些物质,分析是电离为主还是水解为主,这需要根 据题目所给信息进行判断,此类题中等难度,要求学生学会分析问题的能力。
据题目所给信息进行判断,此类题中等难度,要求学生学会分析问题的能力。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种烃的一氯代物只有一种,则这种烃可能是( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有5个碳原子的烷烃 ④分子中具有8个碳原子的烷烃
A.①② B.②③
C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B. 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO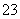 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO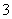 )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
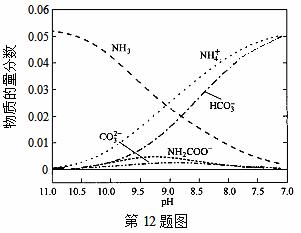
A.在pH=9.0时,c(NH4+)>c(HCO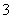 )>c(NH2COOˉ)>c(CO32-)
)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,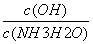 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
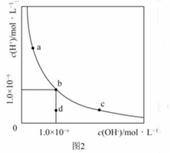 一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.01mol下列物质分别加 入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl()
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列三个热化学方程式
①H2(g)+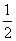 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131 kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com