
| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.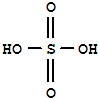 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(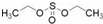 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
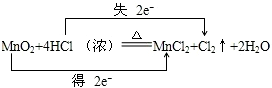 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉生成氢氧化铁和氢气 | |
| B. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| C. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| D. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
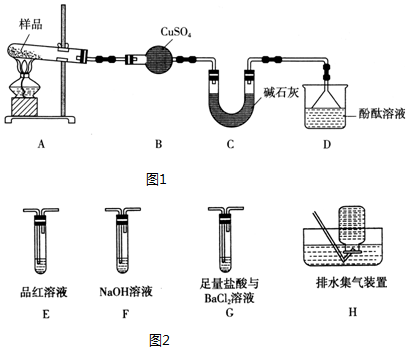
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com