
分析 浓度均为0.1mol•L-1的五种电解质溶液中,①HCl是强酸,②NaOH是强碱,③CH3COOH是弱酸,④NH4Cl是强酸弱碱盐,水解显酸性,⑤NaCl是强酸强碱盐,溶液显中性,据此分析.
解答 解:(1)HCl是一元强酸,CH3COOH是一元弱酸,NH4Cl是强酸弱碱盐,水解显酸性,但酸性比醋酸弱,NaCl是强酸强碱盐,溶液显中性,NaOH是强碱,所以相同浓度的上述溶液,pH由小到大的顺序为①③④⑤②,故答案为:①③④⑤②;
(2)盐酸、醋酸和氢氧化钠会抑制水的电离,氯化钠对水的电离无影响,NH4Cl是强酸弱碱盐,能够水解,速进水的电离,故答案为:④;
(3)盐酸、醋酸溶液稀释时,其氢离子浓度减小,溶液pH增大,氢氧化钠溶液稀释时,氢氧根离子浓度减小溶液pH减小,氯化铵溶液稀释,溶液酸性减弱,溶液pH增大,氯化钠溶液显中性,加水稀释,pH不变,故答案为:⑤.
点评 本题考查了弱电解质的电离、盐类水解等,难度中等,注意影响水的电离平衡移动的因素与影响弱电解质电离平衡移动的因素相同.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
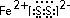 .
.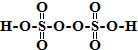
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、空气、醋酸、干冰 | B. | 铁、海水、硫酸钠、乙醇 | ||
| C. | 硫酸、蔗糖、烧碱、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在乙酸乙酯中杂质乙酸时,可先加入饱和烧碱溶液振荡后静置,再分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com