
| A. | 标准状况下,22.4L水含有NA个水分子 | |
| B. | 氧气和臭氧的混合物32 g中含有NA个氧原子 | |
| C. | 7.8g Na2O2与水反应时转移0.1NA个电子 | |
| D. | 1.12L氯气中含有NA个氯原子 |
分析 A.2015标况下,水为液态;
B.氧气和臭氧均由氧原子构成;
C.过氧化钠中的氧元素为-1价,根据过氧化钠与水反应生成的氧气达到物质的量计算出转移的电子数;
D.氯气所处的状态不明确.
解答 解:A.标况下,水为液态,22.4L水的物质的量不是1mol,故A错误;
B.氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为2mol,个数为2NA个,故B错误;
C.7.8g过氧化钠的物质的量为0.1mol,与足量水反应生成0.05mol氧气,转移了0.1mol电子,电子转移了0.1NA,故C正确;
D.氯气所处的状态不明确,不一定是标况,故1.12L氯气的物质的量不一定是0.05mol,氯原子的个数不一定是0.1NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
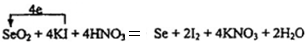 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HF、HCl、HBr、HI | B. | KMnO4、CuCl2、FeCl3,NaCl | ||
| C. | KNO3、KI、AgNO3、Na2CO3 | D. | 溴水、NaCl、NaBr、KI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列叙述正确的是(NA为阿伏加德罗常数的值)
A.7.8gNa2O2含有的共价键数为0.2NA
B.7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA
C.标准状况下,22.4L溴单质含有NA个溴分子
D.0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com