
分析 发生3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2mol/L=0.1mol,由反应可知硝酸过量,溶质只有硝酸钠时Cu2+全部变为Cu(OH)2沉淀,以此计算.
解答 解:①n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2mol/L=0.1mol,由
3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑
0.03mol 0.08mol 0.03mol 0.02mol
可知0.03molCu参加反应消耗硝酸为0.08mol,生成的硝酸铜(铜离子)0.03mol,气体为 0.02mol,其体积为0.02mol×22.4L/mol=0.448 L,
故答案为:0.448L;
②由①知剩余的硝酸0.02mol,剩余的氢离子0.02mol,其浓度为$\frac{0.02mol}{0.5L}$=0.04 mol•L-1,NO3-的物质的量浓度是$\frac{0.1mol-0.02mol}{0.5L}$=0.16mol/L,
故答案为:0.04 mol•L-1;0.16mol/L;
③使反应后溶液中Cu2+全部变为Cu(OH)2沉淀,溶质为硝酸钠,溶液中硝酸根离子为0.08mol,则需要NaOH为0.08mol,氢氧化钠溶液体积为$\frac{0.08mol}{0.2mo/L}$=0.4L,
故答案为:0.4.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意铜离子完全沉淀时溶质为硝酸钠,题目难度不大.


科目:高中化学 来源: 题型:实验题

| 药品 | 作用 | |
| A | FeCl3溶液 | 验证SO2的还原性 |
| B | Na2S溶液 | 验证二氧化硫的氧化性 |
| C | 品红溶液 | 验证二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
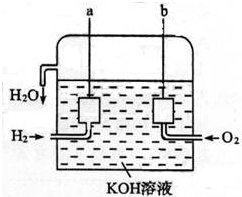
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
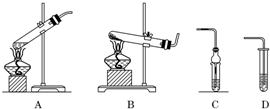
| 实验名称 | 选用的仪器(填字母) | C或D中所盛试剂(填名称) | C或D中的现象 |
| 区别固体Na2CO3和NaHCO3 | BD | 澄清石灰水 | 澄清石灰水变浑浊 |
| 铜和浓硫酸反应 | AC | 品红溶液 | 溶液红色褪去 |
| 制备乙酸乙酯 | AC | 饱和碳酸钠溶液 | 上层有透明油状液体产生并有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石头纸不宜在高温条件下生产 | |
| B. | 石头纸能耐酸和碱的腐蚀 | |
| C. | 石头纸不易燃烧 | |
| D. | 使用石头纸,有利于保护森林,且环保 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红外光谱仪、核磁共振仪都不可用于鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 用水无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 用溴水鉴别乙醇、苯、苯酚、2-己烯 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发可降解高分子材料,减少“白色污染” | |
| B. | 明矾和ClO2都能作为净水剂,其原理完全相同 | |
| C. | 海水淡化和工业生产及生活废水的再生利用,是解决缺水问题的有效途径 | |
| D. | 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com