
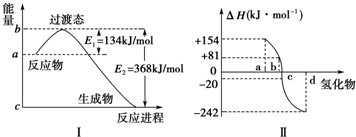
| A. | ②的反应物总能量比①的反应物总能量低 | |
| B. | ①中的I2为固态,②中的I2为气态 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
分析 根据同种物质气态时具有的能量比固态时高,所以等量时反应放出能量高,已知反应①放出能量,反应②吸收能量,所以反应①中碘的能量高,则反应①中碘为气态,据此分析.
解答 解:A.已知反应①放出能量,反应②吸收能量,所以反应①中碘的能量高,所以②的反应物总能量比①的反应物总能量低,故A正确;
B.已知反应①放出能量,反应②吸收能量,所以反应①中碘的能量高,则反应①中碘为气态,②中的I2为固态,故B错误;
C.反应①②的产物都是气态碘化氢,所以二者热稳定性相同,故C错误;
D.根据盖斯定律,②-①为,即I2(s)?I2(g)-35.96KJ,故D错误.
故选A.
点评 本题考查了反应中的能量变化,注意同种物质气态时能量大于固态,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L的氧气所含的分子数为NA | |
| B. | 含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量浓度是0.2mol/L | |
| C. | 1.8gNH4+ 中含有的电子数为NA | |
| D. | 标准状况下,含NA个氮原子的N2 和N2O混合气体中,N2 的体积是5.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇分子中含有醛基 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水就能鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com