
已知:H2(g)+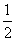 O2(g)===H2O(g) ΔH=-242 kJ/mol,断开1 mol O===O键和1 mol H—O键所吸收的能量分别为496 kJ和463 kJ,则断开1 mol H—H键所吸收的能量为( )
O2(g)===H2O(g) ΔH=-242 kJ/mol,断开1 mol O===O键和1 mol H—O键所吸收的能量分别为496 kJ和463 kJ,则断开1 mol H—H键所吸收的能量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
科目:高中化学 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气)  3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,会发生如下反应(未配平):Mn2++S2O +H2O―→MnO
+H2O―→MnO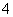 +SO
+SO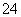 +H+。下列说法正确的是( )
+H+。下列说法正确的是( )
A.该反应中起氧化作用的是Mn2+
B.反应中有1 mol还原剂参加反应时,转移的电子物质的量为4 mol
C.反应后溶液的pH降低
D.该反应常用于检验溶液中Mn2+的存在,现象是溶液紫红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+===M g(OH)2↓
g(OH)2↓
B.向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO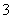 +Ba2++H++SO
+Ba2++H++SO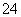 ===BaSO4↓+H2O+CO2↑
===BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO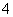 +10H++3H
+10H++3H 2O2===2Mn2++3O2↑+8H2O
2O2===2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO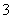 +12H++10I-===Fe2++3NO↑+5I2+6H2O
+12H++10I-===Fe2++3NO↑+5I2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是重要的工业原材料,现有Cu、Cu2O组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol/L的稀硝酸,固体物质完全反应,生成4.48 L(标准状况)的NO。向所得溶液中加入a L 2.0 mol/L的NaOH溶液,恰好使溶液中的Cu2+沉淀完全。
(1)Cu2O与稀硝酸反应的化学方程式为________________。
(2)混合物中,n(Cu)=________;n(Cu2O)=________。
(3)所加NaOH溶液的体积a L=________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)===2N2 (g)+CO2(g)+2H2O(g)
(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A.114.8 kJ B.232 kJ
C.368.8 kJ D.173.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法正确的是( )
2PbSO4(s)+2H2O(l),下列说法正确的是( )
A.放电时,负极的电极反应式为:Pb-2e-===Pb2+
B.放电时 ,正极得电子的物质是PbO2
,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为PbSO4-2e-+2H2O===PbO2+4H++SO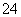
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH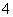 与PH
与PH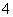 、CH4
、CH4 、BH
、BH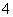 、ClO
、ClO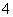 互为等电子体
互为等电子体
c.相同压强下,NH3沸点比PH3的沸点 高
高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________________________________________。
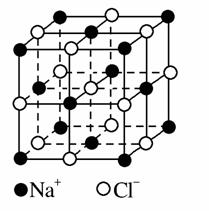
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代 表物,其晶胞结构如图所示。
表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子
表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液,浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com