【答案】
分析:(1)电极均由石墨材料做成,电极过程中阳极生成氧气会和碳反应生成二氧化碳;
(2)以处理过的铝材为阳极,在H
2SO
4溶液中电解,铝材表面形成氧化膜,电解过程中铝做阳极失去电子生成氧化铝,依据原子守恒和电子守恒写出电极反应;
(3)在金属铝表面形成一层抗腐蚀、抗磨损能力的铜镀膜,用铜做阳极,铝做阴极,用含铜离子的电解质溶液做电解质溶液,依据电极反应计算电子转移数;
(4)Al-Ag
2O电池可用作水下动力电源,化学反应为2A1+3Ag
2O+2NaOH+3H
2O═2Na[Al(OH)
4]+6Ag,反应是原电池反应,依据元素化合价变化判断,化合价升高失电子的做负极发生氧化反应,化合价降低得到电子的做电池正极发生还原反应.
解答:解:(1)电极均由石墨材料做成,电极过程中阳极生成氧气会和碳反应生成二氧化碳;阳极不断减少,故答案为:阳极;C+O
2
CO
2;
(2)以处理过的铝材为阳极,在H
2SO
4溶液中电解,铝材表面形成氧化膜,电解过程中铝做阳极失去电子生成氧化铝,依据原子守恒和电子守恒写出电极反应为:2Al+3H
2O-6e
-=Al
2O
3+6H
+,故答案为:2Al+3H
2O-6e
-=Al
2O
3+6H
+;
(3)在金属铝表面形成一层抗腐蚀、抗磨损能力的铜镀膜,用铜做阳极,铝做阴极,用含铜离子的电解质溶液做电解质溶液,当有64g铜析出时,发生电极反应:Cu
2++2e
-=Cu,转移电子物质的量为2mol,计算电子转移数为1.204×10
24,故答案为:铜;1.204×10
24 ;
(4)Al-Ag
2O电池可用作水下动力电源,化学反应为2A1+3Ag
2O+2NaOH+3H
2O═2Na[Al(OH)
4]+6Ag,反应是原电池反应,依据元素化合价变化判断,铝元素化合价升高失电子的做负极发生氧化反应,电极反应为:Al+4OH
--3e
-=[Al(OH)
4]
-;银元素化合价降低得到电子的做电池正极发生还原反应;电极反应为:Ag
2O+H
2O+2e
-=2Ag+2OH
-;正极附近生成了氢氧根离子,附近的pH变大,故答案为:Al+4OH
--3e
-=[Al(OH)
4]
-;变大.
点评:本题考查了电解原理的应用,原电池原理的分析判断,主要是电解原理的分析判断,电极反应书写,原电池的电极反应书写,反应过程中的离子浓度变化,题目难度中等.

 4Al+3O2↑.电极均由石墨材料做成,电解时不断消耗的电极是______(填“阴极’或“阳极”),原因是______ CO2
4Al+3O2↑.电极均由石墨材料做成,电解时不断消耗的电极是______(填“阴极’或“阳极”),原因是______ CO2  CO2;
CO2;

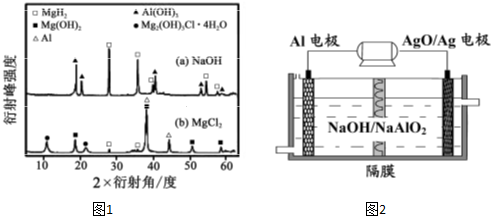
 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.


