
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
分析 A.反应生成氢氧化铝和碳酸氢钠;
B.漏写碳酸氢根离子与碱的反应;
C.醋酸在离子反应中保留化学式;
D.电子、电荷不守恒.
解答 解:A.向NaAlO2溶液中通入过量CO2的离子反应为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故A正确;
B.NH4HCO3溶液中加过量NaOH溶液并加热的离子反应为HCO3-+NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故B错误;
C.用CH3COOH溶解CaCO3的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.Cu溶于稀硝酸HNO3的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:实验题
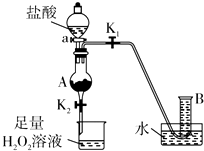 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
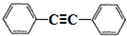 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: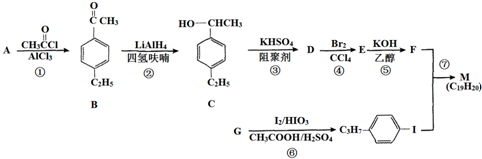
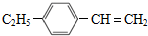 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;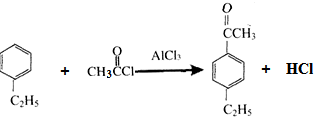 ,④的反应类型是加成反应;
,④的反应类型是加成反应;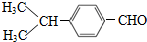 (写结构简式);
(写结构简式);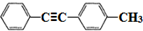 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol/LNaCl溶液含有NA个Na+ | |
| B. | 任意条件下,16gO3所含的原子数为NA | |
| C. | 1molFe与足量稀HNO3反应,转移3NA个电子 | |
| D. | 标准状况下,22.4LSO3所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
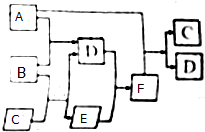 有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,22.4L盐酸含有NA个HCl分子
B.常温常压下,22.4LCO2和SO2混合气体含有2NA个O原子
C.常温常压下,8gCH4含有5NA个电子
D.1mol/LNaCl溶液中含有NA个Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com