
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:

① 0~6 min内,反应的平均速率v(Cl2)= ;
②下列说法不能判断该反应达到化学平衡状态的是 。(填字母)
A.体系中Cl2的转化率不变
B.体系中气体的平均摩尔质量不再改变
C.每消耗1mol CO的同时生成1mol COCl2
D.混合气体密度不变
③随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
④比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) T(15)
(填“<”、“>”或“=”)。
⑤若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡
移动(填“向正反应方向”、“向逆反应方向”或“不”);
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)如图所示,利用电化学原理将SO2 转化为重要化工原料C
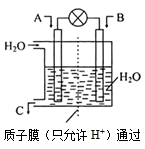
若A为SO2,B为O2,则负极的电极反应式为:________________________;
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2016届江苏省苏北四市高三上学期期中质量抽测化学试卷(解析版) 题型:实验题
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。已知它易溶于水,难溶于乙醇,加热易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
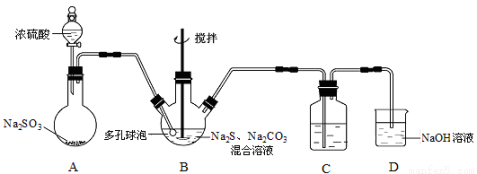
(1)装置A中发生反应的化学方程式是 。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为 ,生成的硫代硫酸钠粗品可用 洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是 ,表明SO2吸收效率低的实验现象是C中溶液 。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 (写出一条)。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为: (实验中供选用的试剂及仪器: CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管。提示:室温时CaCO3饱和溶液的pH=9.5)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州地区七校高一上学期期中联考化学试卷(解析版) 题型:实验题
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置。装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol·L-1。
不同时间电子天平的读数如下表所示:
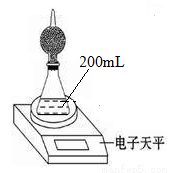
实验操作 | t/min | 电子天平的读数/g |
装置+硫酸溶液 | 320.0 | |
装置+硫酸溶液+样品 | 0 | 335.0 |
1 | 334.5 | |
2 | 334.1 | |
3 | 333.8 | |
4 | 333.8 |
(1)反应中生成气体的质量为 。
(2)试计算样品中铝的质量分数?(写出计算过程)
(3)求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度? (写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州地区七校高一上学期期中联考化学试卷(解析版) 题型:选择题
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体依次是什么。
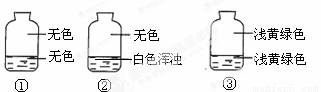
A.AgNO3溶液、NaOH溶液、水 B.NaOH溶液、AgNO3溶液、水
C.水、AgNO3溶液、NaOH溶液 D.AgNO3溶液、水、NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州地区七校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列物质的水溶液能导电,但属于非电解质的是
A.HNO3 B. Cl2 C.NH4NO3 D. SO3
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是
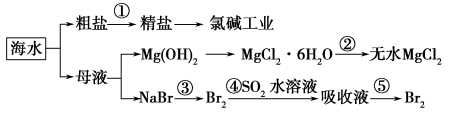
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:
NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第④步的目的是为了浓缩富集溴
查看答案和解析>>
科目:高中化学 来源:2016届广东省、潮州金中高三上学期期中联考理综化学试卷(解析版) 题型:填空题
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
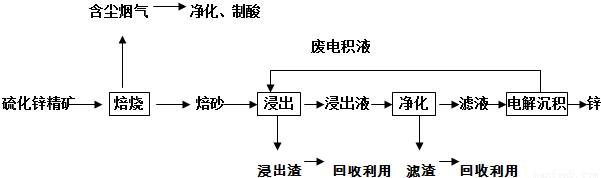
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌,碳生成CO)
查看答案和解析>>
科目:高中化学 来源:2016届江西省新余、 万载、宜春三校高三上学期10月联考化学试卷(解析版) 题型:选择题
现有KCl和KBr的混合物3.87 g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63 g沉淀物,则原混合物中钾元素的质量分数为
A.24.1% B.25.9% C.40.3% D.48.1%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第一次月考化学试卷(解析版) 题型:实验题
(12分)某同学预设计实验测定H2在通常状况下的摩尔体积,设计如下实验步骤:①连接如图所示装置,并检查装置的气密性
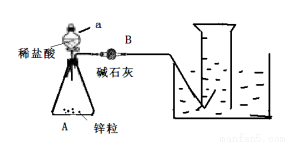
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为a g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为c g;
⑦处理数据等。
(1)写出A仪器中发生反应的化学方程式
(2)写出检查该装置气密性的方法
(3)A装置中仪器a的名称为
(4)若拆除B仪器(其他仪器不变), (填“会”或“不会”) 对本实验产生影响,理由是
(5)根据上述数据,计算在通常状况下,H2的摩尔体积Vm= (用含a、b、c等字母的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com