
 �״���CH3OH���Ͷ����ѣ�CH3OCH3������Ϊ21���͵�����ȼ�ϣ�������ࡢ�{Ч�����������ܣ�
�״���CH3OH���Ͷ����ѣ�CH3OCH3������Ϊ21���͵�����ȼ�ϣ�������ࡢ�{Ч�����������ܣ����� | CH3OCH3��g�� | H20��g�� | |
| Ũ�ȣ�mol?L-1�� | 0.60 | 0.60 |
| ���� | ��2 | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO��2molH2 | 1molCH3OH | 2molCO��4molH2 |
| CH3OH | c1=0.25 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | a1 | a2 | a3 |
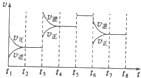
| t1-t2 | t4-t5 | t5-t6 | t7-t8 |
| K4 | K5 | K6 | K7 |
| 0.6��0.6 |
| 0.442 |
| (0.6+x)2 |
| (0.44-2x)2 |
| 0.8mol/L |
| 10min |


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1mol NH3�����е�ԭ����ΪNA |
| B�����³�ѹ�£�22.4L����������ԭ����Ϊ3NA |
| C�����³�ѹ�£�48gO2��O3�Ļ�����к��е���ԭ����Ϊ3NA |
| D��1mol/L��NaCl��Һ������Na+ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
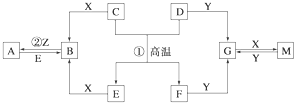
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
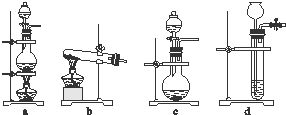
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͨ�������ĵ缫Ϊ���� |
| B���μӷ�Ӧ��O2��C2H6�����ʵ���֮��Ϊ7��2 |
| C���ŵ�һ��ʱ���KOH�����ʵ���Ũ�Ƚ��½� |
| D���ŵ�һ��ʱ���������������Һ��pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Һa�д��ڳ����ܽ�ƽ�⣺Mg��OH��2��s���TMg2+��aq��+2OH-��aq�� |
| B����Һb�в�����Mg2+ |
| C��������ɫ�仯˵��Mg��OH��2ת��ΪFe��OH��3 |
| D��ʵ�����֤��Fe��OH��3��Mg��OH��2������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com