
分析 (1)碳酸钙和盐酸反应生成氯化钙、水、二氧化碳;
(2)氢氧化钡溶液和硫酸溶液发生复分解反应生成硫酸钡和水;
(3)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应;
(4)H++OH-═H2O该离子方程式可表示强酸与可溶性强碱溶液反应生成可溶性盐和水的反应.
解答 解:(1)盐酸的酸性强于碳酸,碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,离子反应为CaCO3+2H+=CO2↑+H2O+Ca2+,
故答案为:CaCO3+2H+=CO2↑+H2O+Ca2+;
(2)氢氧化钡溶液和硫酸溶液反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如:Na2CO3+2HCl=CO2↑+H2O+2NaCl,
故答案为:Na2CO3+2HCl=CO2↑+H2O+2NaCl;
(4)H++OH-=H2O表示可溶性强碱与强酸反应生成可溶性盐和水的反应,如:HCl+NaOH=NaCl+H2O,
故答案为:HCl+NaOH=NaCl+H2O.
点评 本题考查了方程式的书写,题目难度不大,注意掌握离子方程式的概念、表示意义及书写原则,明确需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要区别离子方程式满足守恒关系,如:质量守恒定律、电荷守恒、电子守恒.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所得电荷数SO42-是Na+的0.4倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阴极上析出红色固体 | |
| B. | 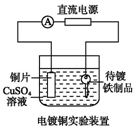 装置的待镀铁制品应与电源负极相连 | |
| C. | 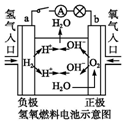 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 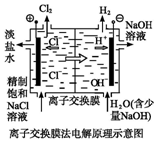 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中是否混有乙酸,可以加石蕊试液进行检测 | |
| B. | 乙醇中是否混有乙酸,可以加入金属钠进行检验 | |
| C. | 乙酸乙酯、乙酸均能与NaOH反应,二者分子中的官能团相同 | |
| D. | 淀粉和蛋白质均可水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 | |
| B. | 平衡后c(Cl2)=2.5×10-2mol/L | |
| C. | 其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
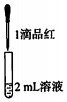 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
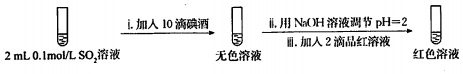
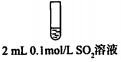
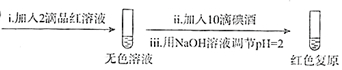
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
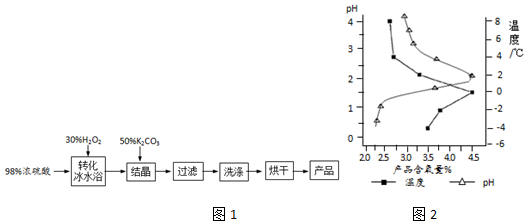
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com