
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | Fe3++Fe?2Fe2+ | D. | HNO3?H++NO3- |
分析 A.水为弱电解质,在溶液中电离出水合氢离子和氢氧根离子;
B.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.硝酸为强电解质,电离方程式应该用等号.
解答 解:A.水能够电离出氢离子和氢氧根离子,其电离方程式为:H2O+H2O?H3O++OH-,故A正确;
B.碳酸根离子分步电离,主要以第一步为主,其电离方程式为:CO32-+H2O?HCO3-+OH-,故B正确;
C.铁离子与铁反应生成亚铁离子,正确的离子方程式为:2Fe3++Fe?3Fe2+,故C错误;
D.硝酸为强电解质,在溶液中完全电离,其电离方程式为:HNO3=H++NO3-,故D错误;
故选CD.
点评 本题考查了电离方程式、离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握电离方程式、离子方程式的书写原则,试题侧重考查学生的分析能力及规范答题能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:多选题
| A. | 10min内,X的平均反应速率为0.03mol/(L•min) | |
| B. | 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态 | |
| C. | 10min后Z的浓度为0.7mol/L | |
| D. | 10min内,反应放出的热量为0.3aKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 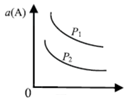 图:p1>p2,则此反应只能在高温下自发进行 | |
| B. |  图:此反应的△H<0,且T1<T2 | |
| C. |  图:表示t1时刻一定是使用催化剂对反应速率的影响 | |
| D. |  图:表示t1时刻增大B的浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2g H2中含有的氢原子数为2NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 1L 0.1mol/L NaCO3溶液中含有的钠离子数为NA | |
| D. | 将1mol Cl2通入足量FeCl2溶液中充分反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3 | B. | Fe(OH)2→Fe(OH)3 | C. | N2→NH3 | D. | Na2O2→Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com