
下列离子方程式正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO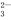 ===CO2↑+H2O
===CO2↑+H2O
B.氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
C.氯化铝溶液加入氨水:Al3++3OH-===Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH +OH―
+OH― NH3↑+H2O
NH3↑+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:实验题
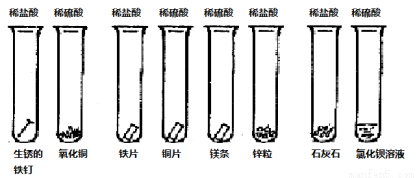
同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(1)这8个实验是如何分组的?请写出各组的试管编号:第一组 第二组 第三组 ,你认为如此分组的依据是: 。
(2)写出试管②⑤的实验现象及有关的离子方程式:
② ;  。
。
⑤ ; 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①___________________________________;
②___________________________________;
③____________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:填空题
化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
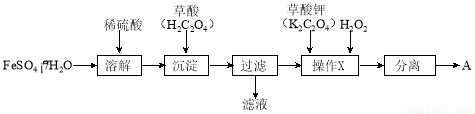
① 上述流程中,检验“过滤”后的固体已洗涤干净的方法是 。
② 上述流程“操作X”中加入H2O2的目的是  。
。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
通过计算填空,请写出解题过程。
① 4.91g A样品中含结晶水的物质的量为 mol。
② A样品中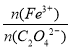 = 。
= 。
③ A的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列有关Na2CO3和NaHCO3性质的说法中,不正确的是
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3
C.106 g Na2CO3和84 g NaHCO3分别与过量盐酸反应,放出CO2的质量相等
D.Na2CO3和NaHCO3均可与澄清石灰水反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列化学用语表达正确的是
A.硫原子的结构示意图: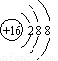
B.氯化氢分子的电子式: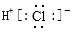
C.乙烯的结构简式:CH2CH2
D.碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
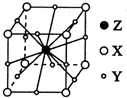 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.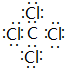
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com