
【题目】(1)有以下四种物质 ①22g二氧化碳;②5g氢气;③1.204╳1024个氮气分子; ④4℃时18g水,它们所含分子数最多的是_________________;质量最大的是____________;常温时体积最大的是_______________ (填序号)。
(2)V L Fe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为________mol·L-1
(3)标况下,mg 气体A和ng气体B具有相等的体积,则同温同压下的密度之比为________, 同质量的A、B的分子数目之比为________。
(4)在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为_____________、_________________。
【答案】② ③ ② ![]() m:n n:m 6.4mol 0.2mol
m:n n:m 6.4mol 0.2mol
【解析】
(1)依据n=![]() =
=![]() ,m=ρV,结合物质的结构组成解答;
,m=ρV,结合物质的结构组成解答;
(2)根据n=![]() ,计算出mg铁离子的物质的量,再根据硫酸铁的化学式计算出硫酸根离子的物质的量,最后根据c=
,计算出mg铁离子的物质的量,再根据硫酸铁的化学式计算出硫酸根离子的物质的量,最后根据c=![]() 计算出溶液中硫酸根离子的浓度;
计算出溶液中硫酸根离子的浓度;
(3)根据ρ=![]() 可知体积相同时,二者密度与质量成正比;标况下二者体积相同,则A与B的物质的量相同,根据M=
可知体积相同时,二者密度与质量成正比;标况下二者体积相同,则A与B的物质的量相同,根据M=![]() 可知二者摩尔质量与其质量成正比,同质量的A与B分子个数之比等于摩尔质量的反比;
可知二者摩尔质量与其质量成正比,同质量的A与B分子个数之比等于摩尔质量的反比;
(4)配制的溶液中的钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量;
①22g二氧化碳物质的量为![]() =0.5mol,含有分子个数为0.5mol×NA=0.5NA;
=0.5mol,含有分子个数为0.5mol×NA=0.5NA;
②5g氢气物质的量为:![]() =2.5mol, 含有分子个数为2.5mol×NA=2.5NA;
=2.5mol, 含有分子个数为2.5mol×NA=2.5NA;
③1.204×1024个氮气分子数即2NA,物质的量为:![]() =2mol,质量为:2mol×28g/mol=56g,
=2mol,质量为:2mol×28g/mol=56g,
④4℃时18mL水,质量为1g/ml×18mL=18g,物质的量为:![]() =1mol,含有分子个数为1mol×NA=NA;
=1mol,含有分子个数为1mol×NA=NA;
(1) ①二氧化碳含有分子个数为0.5mol×NA=0.5NA;②5g氢气含有分子个数为2.5mol×NA=2.5NA;③1.204×1024个氮气分子数即2NA;④18mL水含有分子个数为1mol×NA=NA,它们所含分子数由大到小的顺序是②③④①;①22g二氧化碳②5g氢气③1.204×1024个氮气分子质量为:2mol×28g/mol=56g,④4℃时18g水,质量最大的是③;n=![]() ,常温时,物质的量越大,气体的体积越大,由于水是液体,体积最小,常温时体积最大的是②,
,常温时,物质的量越大,气体的体积越大,由于水是液体,体积最小,常温时体积最大的是②,
故答案为:②;③;②。
(2)VLFe2(SO4)3溶液中含Fe3+mg,含有铁离子的物质的量为:![]() =
=![]() mol,溶液中含有硫酸根离子的物质的量为:
mol,溶液中含有硫酸根离子的物质的量为:![]() mol×
mol×![]() =
=![]() mol,则溶液中SO42的物质的量浓度为:
mol,则溶液中SO42的物质的量浓度为: =
=![]() mol/L,
mol/L,
故答案为:![]() ;
;
(3)标况下,mg 气体A和ng气体B具有相等的体积,根据ρ=![]() ,可知同温同压下的密度与质量成正比,则二者密度之比=mg:ng=m:n;标况下二者体积相同,则A与B的物质的量相同,根据M=mn可知二者摩尔质量与其质量成正比,则二者摩尔质量之比=m:n,根据n=
,可知同温同压下的密度与质量成正比,则二者密度之比=mg:ng=m:n;标况下二者体积相同,则A与B的物质的量相同,根据M=mn可知二者摩尔质量与其质量成正比,则二者摩尔质量之比=m:n,根据n=![]() =
=![]() 可知,相同质量的A、B含有分子数与其摩尔质量成反比,则同质量的A、B的分子数目之比为n:m,
可知,相同质量的A、B含有分子数与其摩尔质量成反比,则同质量的A、B的分子数目之比为n:m,
故答案为:m:n;n:m;
(4)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol6.4mol=0.2mol,
故答案为:6.4mol;0.2mol;


科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
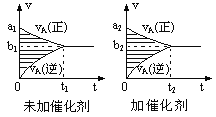
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
A. ②④⑤⑦B. ①④⑥⑧C. ②③⑤⑧D. ①③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3、ClO、CNO(C+4价,N-3价)、Cl等微粒。下列说法不正确的是

A.该废水呈强酸性
B.废水处理后转化为无害物质
C.反应的离子方程式:3ClO+2CNO+H2O == N2+2HCO3+3Cl
D.每处理1 mol CNO转移3 mol e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O。下列结论正确的是
A.氧化性:Cl2>KClO3
B.HCl作还原剂,全部被氧化
C.KClO3 作氧化剂,具有氧化性
D.生成3 mol Cl2 ,转移电子的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含的质子数由多到少是:CO2>SO2>CH4>O2>H2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A. c1∶c2=3∶1B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率相等D. c1的取值范围为0.04 mol·L-1 < c1 < 0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“锌”和“碳棒”作为导电材料,根据氧化还原反应H2SO4+Zn=ZnSO4+H2↑,设计如下原电池装置:
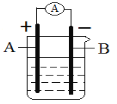
⑴该原电池电解质溶液中的溶质是________。
⑵电极A是________,该电极反应现象为_______。
⑶电极B是______,该电极反应现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应的平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)9.8gH2SO4的物质的量是___;写出硫酸的电离方程式_____________________。
(2)0.25 molCaCO3的质量是______;其与足量的盐酸反应生成二氧化碳在标准状况下的体积为______。
(3)写出实验室制氯气的化学方程式___________________________________。
(4)检验溶液中是否含有Fe3+可向溶液中加入几滴硫氰化钾溶液,现象是______除去FeCl3溶液中少量的FeCl2可将____通入溶液中。
(5)铝分别于足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com