
下列离子方程式正确的是 ( )
A.浓硝酸中加入过量铁粉并加热:Fe+3NO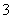 +6H+=Fe3++3NO2↑+3H2O
+6H+=Fe3++3NO2↑+3H2O
B.Ca(HCO3)2溶液与过量NaOH溶液反应 HCO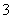 +OH-+Ca2+===CaCO3↓+H2O
+OH-+Ca2+===CaCO3↓+H2O
C.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+===Fe3++3H2O
D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++2OH-+NH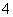 +HCO
+HCO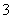 ===BaCO3↓+NH3·H2O+H2O
===BaCO3↓+NH3·H2O+H2O
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
工业上用H2和N2直接合成氨:N2+3H22NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度
④增大压强
A.只有①②③ B.只有①②④
C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
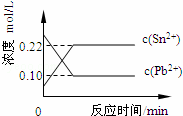 |
|
| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 |
|
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
|
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
|
| D. | 25℃时,该反应的平衡常数K=2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1)已知Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 + H2O 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
其他条件不变时:探究浓度对化学反应速率的影响,应选择____________。(填实验编号);
探究温度对化学反应速率的影响,应选择____________。(填实验编号)。
(2)甲同学设计如下实验流程探究Na2S2O3的化学性质。
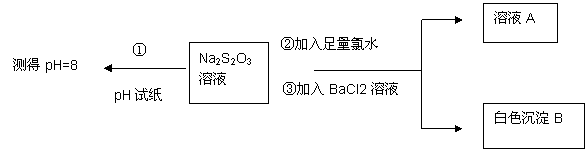
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和____________ 性。
(Ⅱ)生成白色沉淀B的离子方程式是 ____________。
(Ⅲ)已知Na2S2O3溶液与Cl2反应时, 1mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中,下列离子组能大量共存的是( )
A.Na+、Al3+、NO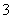 、Cl- B.K+、Na+、Cl-、AlO
、Cl- B.K+、Na+、Cl-、AlO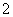
C.Fe2+、K+、NO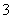 、Cl- D.Na+、HCO
、Cl- D.Na+、HCO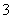 、K+、NO
、K+、NO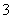
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于
过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是( )
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,得到的不溶物为Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示。F和J是中学化学中常见的两种单质。H为红棕色气体。图中部分反应条件及生成物没有列出。请按要求填空:
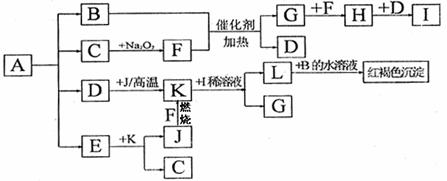
(1)单质F的化学式
(2)写出B和F反应的化学方程式 ,L和B的水溶液反应的离子方程式 ;
(3)写出K与I的稀溶液反应的离子方程式
(4)A的化学式为
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G生成,该反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用电石渣(主要含CaO、CaC2及少量C、SiO2)为原料制备氯酸钾的实验流程及相关物质的溶解度如下:
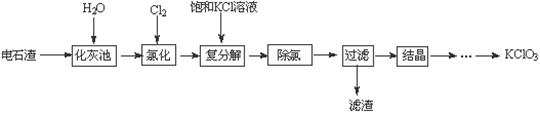
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(1) 化灰池中CaC2与水反应的化学方程式为 。
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为 ;除去溶液中多余的氯气的简单方法是 。
(3)饱和KCl溶液能与氯酸钙反应的原因是 。
(4)滤渣中的成分主要是 (写化学式);从过滤后的溶液中获得KClO3晶体的方法是 、 、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是
A.P2O5可用于干燥C12和NH3 B.“可燃冰”主要成分是甲烷和水
C.CC14 可用于鉴别溴水和碘水 D.Si和SiO2都用于制造光导纤维
可用于鉴别溴水和碘水 D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com