
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
分析 (1)压强从2×105Pa增加到5×105 Pa时,D的浓度应变化应该为0.2125mol/L,而图表中变化为0.20mol/L<0.2125mol/L,说明平衡逆向进行;
(2)5×106 Pa 增加到1×106 Pa时,D的浓度应变化为0.20mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行.
解答 解:(1)压强从2×105Pa增加到5×105 Pa时,D的浓度应变化为0.085mol/L的2.5倍即为0.2125mol/L,而图表中变化为0.20mol/L<0.2125mol/L,说明平衡逆向进行,
故答案为:左;D浓度增大的倍数小于压强增大的倍数;
(2)压强从5×106 Pa 增加到1×106 Pa时,D的浓度应变化为0.20mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行,其原因是D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小,
故答案为:右;D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成物的气体体积减小.
点评 本题考查了化学平衡状态的影响因素,为高考常见题型和高频考点,关键是分析题中表格的数据,得出正确结论,充分考查了学生的分析、理解能力,本题难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
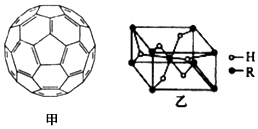
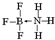 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
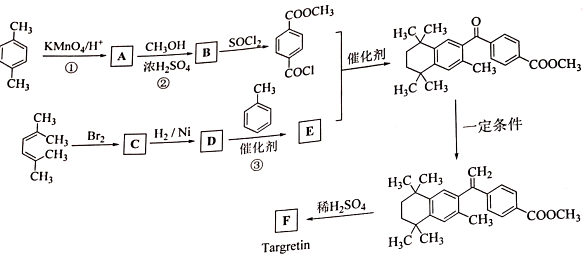
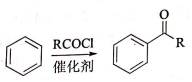 ②
②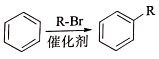
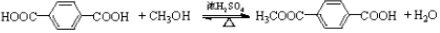 .
.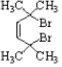 .
.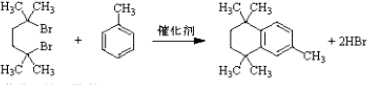 .
.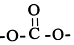 结构)
结构)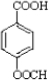 ,
,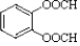 .
.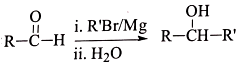 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)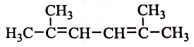 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
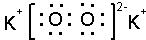 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnC2水解生成C2H2 | B. | A14C3水解生成C3H4 | ||
| C. | Mg2C3水解生成C3H4 | D. | Li2C2水解生成C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com