
【题目】缺硼时,植物会表现出一定的病症,在有该病症的植株叶面上喷施很少量的一定浓度的含硼溶液后,该病症消失,这说明硼是植物体的( )
A. 大量元素,必需元素B. 大量元素,非必需元素
C. 微量元素,非必需元素D. 微量元素,必需元素
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 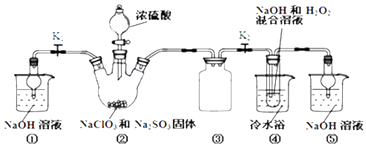
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测,氨有望取代氢能,成为重要的新一代绿色能源.下列有关说法不正确的是( )
A.液氨作为清洁能源的反应原理是4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g?L﹣1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJmol﹣1)P﹣P:198 P﹣O:360 O═O:498则反应P4(白磷)+3O2→P4O6的能量变化为( ) 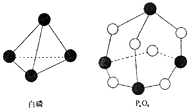
A.释放1638kJ的能量
B.吸收1638kJ的能量
C.释放126kJ的能量
D.吸收126kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:Br<Fe2+。往100ml溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有1/2的Br被氧化成Br2。则原溴化亚铁溶液的物质的量浓度为
A. 1.0mol/L B. 1.5mol/L C. 1.1mol/L D. 1.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( ) 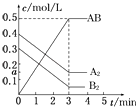
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2 ![]() 2AlON+CO合成,下列有关说法正确的是( )
2AlON+CO合成,下列有关说法正确的是( )
A.氮氧化铝中氮的化合价是﹣3
B.反应中氧化产物和还原产物的物质的量之比是2:1
C.反应中每生成5.7g AlON 同时生成1.12 L CO
D.反应中氮气被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答有关合金的知识。
(1)电器修理中所用的焊锡是锡铅合金,它的熔点比纯铅的熔点_________(填“高”或“低”);镁铝合金用于飞机制造,其硬度比纯铝的硬度_____________(填“大”或“小”)。
(2)古代的“药金”外观与金相似,常被误认为是金子。将碳酸锌、木炭、赤铜(Cu2O)混合加热到800℃,就可得到金光闪闪的“药金”。“药金”的主要成分是__________。有关的化学方程式是 ___________________;_____________;________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com