
【题目】有四瓶常用溶液:①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液.不用其他试剂,可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是( )
A.④①③②
B.①③④②
C.①④③②
D.①④②③
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
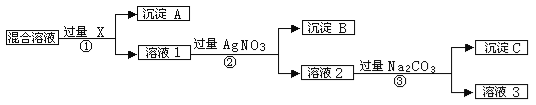
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Fe3+、SO42﹣、Al3+和M四种离子以物质的量之比为1:5:2:1共同存在于同一种溶液中,那么M离子可能是( )
A.Mg2+
B.Ba2+
C.Na+
D.NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为0.1 mol/L的MOH、ROH两种碱溶液中不断加水稀释,溶液的pH与溶液浓度的对数(lgc)间的关系如图。下列说法错误的是

A. Kb(MOH)的数量级为10-5
B. a、b两点溶液中,水的电离程度:a<b
C. 等体积等浓度的ROH和MCl混合后所得溶液中:c(OH-)>c(H+)
D. 用相同浓度的盐酸分别中和a、b两点溶液,消耗盐酸体积:Va>Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
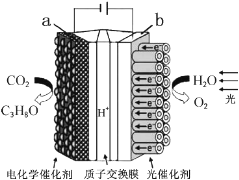
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列微粒中,只有氧化性的是_____________ (用字母填写,下同),既有氧化性又有还原性的是___________________。
A. Cl2 B. S2— C. H+ D. Na E. FeCl2
(2)在4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O反应中
MnCl2+Cl2↑+2H2O反应中
①氧化剂是________,氧化产物是________;
②被氧化与未被氧化的HCl的质量之比为_______,若有7.3gHCl被氧化,转移电子的物质的量为________;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为________________
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色) ![]() Q(还原性,无色)
Q(还原性,无色)
(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、___________、______________
(4)如何判断滴定达到终点:_______________________________
(5)步骤2的主要作用是________________
(6)硫酸亚铁铵溶液的标定浓度是___________mol/L(保留三位有效数字)
(7)若滴定前锥形瓶中有水,对测定结果的影响是______(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com