
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)2NH3(g)达到平衡时生成NH3的物质的量为 m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________mol(从下列各项中选择,只填字母,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于m
C.在m~2m之间 D.等于2m
E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入______mol N2和________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国航天飞机“哥伦比亚号”爆炸,是震惊世界的航天惨案。专家推测“哥伦比亚”航天飞机的失事原因之一是覆盖在航天飞机外层的一片微不足道的隔热瓦脱离,引起飞机外表金属温度迅速升高而熔化解体。
(1)其中照片显示,在“哥伦比亚号”机翼下方有几片小瓷片脱落,引起了科学家的注意,这是一种覆盖在航天飞机表面的特殊的陶瓷片,其主要作用是__________________________________________________________。
A.增加航天飞机的强度,防止流星和太空垃圾撞击而损坏航天飞机
B.将太阳能转化为电能供航天飞机使用
C.便于雷达跟踪,接受地面指挥中心的指令
D.在返回大气层时,陶瓷耐高温隔热,有效地保护航天飞机平安返回地面
(2)隔热瓦是一种金属陶瓷,金属陶瓷是由陶瓷和黏结金属组成的非匀质的复合材料。陶瓷主要是Al2O3、ZrO2等耐高温氧化物,黏结金属主要是Cr、Mo、W、Ti等高熔点金属。下列关于复合材料的说法不正确的是________。
A.由两种或两种以上金属(或金属与非金属)熔合而成的物质叫复合材料
B.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,在综合性能上超过了单一材料
C.玻璃钢是以玻璃纤维和树脂组成的复合材料,它可做船体、汽车车身等,也可做印刷电路板
D.复合材料的熔、沸点一般比它的各组成成分的熔、沸点低
(3)将陶瓷和黏结金属研磨,混合均匀,成型后在不活泼气氛中烧结,就可制得金属陶瓷。金属陶瓷兼有金属和陶瓷的优点,其密度小、硬度高、耐磨、导热性好,不会因为骤冷或骤热而脆裂。实验室有一金属陶瓷制成的容器,可用来盛放下列哪些物质________。
A.NaOH溶液 B.KNO3溶液
C.氢氟酸 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是
( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2O2投入FeCl2溶液中
A.只有①④ B.只有③
C.只有②③ D.只有①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
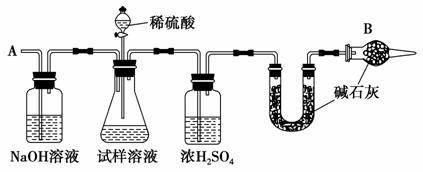
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________________________________________________________________________。
(2)装置中干燥管B的作用是_____________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(4)步骤⑤的目的是________________________________________。
(5)步骤⑦的目的是_______________________________________________。
(6)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。
(7)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种不同的实验方法_______________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11,它的Ka1、Ka2差别很大的原因(从电离平衡的角度解释):_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时加水稀释10 mL pH=11的氨水,下列判断正确的是( )
A.原氨水的浓度为10-3mol·L-1
B.溶液中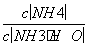 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各组物质关系的描述中不正确的是( )
A.O2和O3互为同素异形体
B.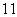 H、
H、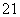 H和
H和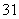 H互为同位素
H互为同位素
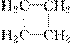 |
C.CH2===CH2和 互为同系物
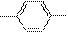 | |||
 | |||
D. C2H5和H3C CH3互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com