
| 100 |
| x |
| 44 |
| 22g |
| 111 |
| y |
| 44 |
| 22g |
| 50g |
| 53g |
| 55.5g |
| 196g-(53g-50g) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
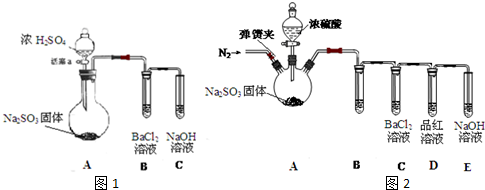
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
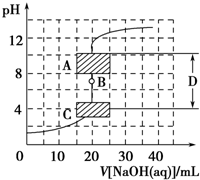 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用饱和NaHCO3溶液除去CO2中少量的HCl |
| B、NH4C1和I2的固体混合物可以用加热的方法分离 |
| C、植物油和水的混合物可以用分液的方法分离 |
| D、溴水中的溴单质可以用四氯化碳萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
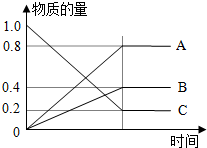 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com