
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 >HSO3->
>HSO3->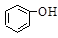 水杨酸(
水杨酸( )与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
)与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是A. + SO32―→ + SO32―→ + HSO3― + HSO3― |
B. + SO32―→ + SO32―→ +HSO3― +HSO3― |
C.2 + SO32―→2 + SO32―→2 +SO2↑+H2O +SO2↑+H2O |
D. +2SO32―→ +2SO32―→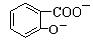 +2HSO3― +2HSO3― |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯水在25 ℃和100 ℃时的pH |
| B.CH3COONa溶液中Na+和CH3COO-的浓度 |
| C.相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D.用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( ) | A.加入盐酸 | B.加入NaOH(s) | C.加蒸馏水 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2C2O4 +CO32-= HCO3-+HC2O4- | B.HC2O4-+CO32-= HCO3-+C2O42- |
| C.H2C2O4 +HCO3-=HC2O4-+H2O+CO2 | D.H2C2O4+CO32-= C2O42-+H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温时,测得乙酸钠溶液的pH>7 |
| B.常温时,测得0.1 mol·L-1乙酸溶液的pH约为3 |
| C.乙酸溶液与大理石反应产生气泡 |
| D.相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH增大 | B.CH3COOH的电离程度增大 |
| C.溶液的导电能力减小 | D.溶液的c(OH-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com