
| A、纯碱溶液呈碱性的原因是:CO32-+2H2O=H2CO3+2OH- | ||||
B、用惰性电极电解MgCl2溶液:Mg2++2Cl-+2H2O
| ||||
| C、乙烯的结构简式:CH2CH2 | ||||
| D、在原电池和电解池中均可发生的电极反应:4OH--4e-=O2↑+2H2O |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.物质T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2=Ca2++2(OH-) |
| B、FeCl3=Fe2++3Cl- |
| C、Al2(SO4)3=2Al3++3SO42- |
| D、H2SO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液 | B、悬浊液 |
| C、乳浊液 | D、胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 1.6 | 3 |
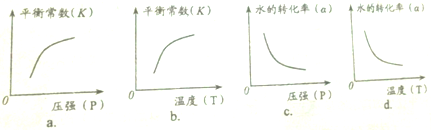
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
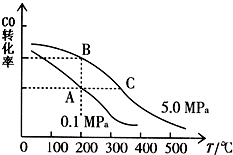 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com