
下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是( )
A.K2SO4 B.Na2CO3 C.(NH4)2SO4 D.NH4HCO3
科目:高中化学 来源: 题型:
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1]:
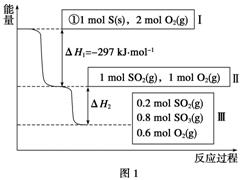
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:__________________。
(2)ΔH2=____________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为________,若溶液中发生了氧化还原反应,则该过程的离子方程式为____________。
(5)恒容条件下,下列措施中能使2SO2(g)+O2(g)2SO3(g)中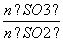 增大的有________。
增大的有________。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
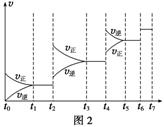
(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 。用惰性电极电解B、C两元素组成的化合物的水溶液的化学方程式为 。
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为 ,其基态原子的价电子排布图为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向密闭容器中充入1.0 mol N2和3.0 mol H2,反应达到平衡时,测得NH3的物质的量为0.6 mol。若该容器中开始时N2的物质的量为2.0 mol,H2为6.0 mol,则平衡时NH3的物质的量为( )
A.若为定容容器,n(NH3)=1.2 mol
B.若为定容容器,n(NH3)<1.2 mol
C.若为定压容器,n(N H3)=1.2 mol
H3)=1.2 mol
D.若为定压容器,n(NH3)>1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH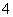 )分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
)分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、
HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是__________________________。
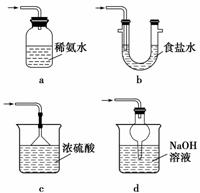
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO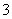 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
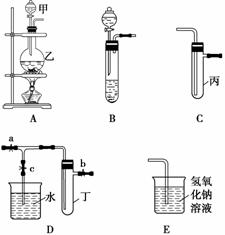
(1)实验室将B、C、E相连后,以浓盐酸和________(填写名称)为原料可制取Cl2,为接下来研究氯气的化学性质做准备。
(2)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象及结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
请你评价:
实验Ⅰ推出相应结论是否合理?________________。若不合理,请说明理由(若合理,则无需填写此空):______________________。
实验Ⅱ推出相应的结论是否合理?______________若不合理,请说明理由(若合理,无需填写此空):____________________。
(3)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱。A中反应的离子方程式为________________________,丙中应放入的试剂是____________。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2,欲用D装置验证NO2与水的反应,其操作步骤为先关闭止水夹________,再打开止水夹c,使烧杯中的水进入试管丁的操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作或结论的叙述中不正确的是( )
|
|
|
|
|
| A.除去CO2中的HCl | B.溶液变红,待测液中含Fe3+ | C.有砖红色沉淀,葡萄糖中含醛基 | D.有白烟出现,浓盐酸有挥发性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com