
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.分析 A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,据此进行解答.
解答 解:A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,
(1)质子数相同、中子数不同的原子之间互为同位素,则A的该3种核素互为同位素;B为N元素,其原子序数为7,位于周期表中第二周期VA族;B的氢化物为氨气,氨气溶于水存在平衡:NH3+H2O?NH3•H2O?NH4++OH-,所以其水溶液显示碱性,
故答案为:同位素;第二周期VA族;NH3+H2O?NH3•H2O?NH4++OH-;
(2)C为Al元素,铝原子的核电荷数为13、最外层为3个电子,其原子结构示意图为: ;Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
;Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为: ;2Al+2H2O+2OH-=2AlO2-+3H2↑;
;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)D的单质为氯气,A的该氢化物为水,氯气与水反应生成氯化氢和次氯酸,次氯酸具有漂白性,反应的化学方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;
(4)D的最高价氧化物对应的水化物为高氯酸,其分子式为HClO4,由于氯元素的非金属性大于S元素,则高氯酸的酸性大于H2SO4,故答案为:HClO4;强.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
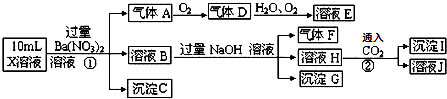
| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com