
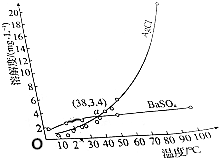
| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
分析 由图象可知升高温度,AgCl的溶解度变化较大,可知AgCl的溶解为吸热过程,则可以用重结晶的方法分离AgCl和BaSO4,a点时,二者溶解度相等,溶液质量分数相等,以此解答该题.
解答 解:A.a点时,AgCl和BaSO4溶解度相等,如水为100g,溶质质量相等,体积相近,密度基本相同,故A正确;
B.由图象可知升高温度,AgCl的溶解度变化较大,可知AgCl的溶解为吸热过程,故B正确;
C.由图象可知室温时,AgCl溶解度较小,则向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,平衡逆向移动,则析出BaSO4沉淀的质量比AgCl多,故C正确;
D.AgCl和BaSO4的溶解度都很小,不可以用重结晶的方法分离AgCl和BaSO4,故D错误.
故选D.
点评 本题考查了难溶电解质的溶解平衡及其应用,题目难度中等,正确理解溶度积曲线是解本题关键,结合溶度积常数来分析解答,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题

| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
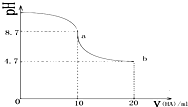
| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
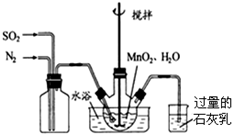
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
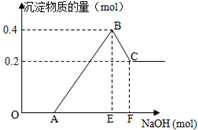 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色NO 2加压后颜色先变深后变浅 2NO2?N2O4 | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 | |
| D. | H2、I2、HI平衡混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铍的最高价氧化物的水化物可能具有两性 | |
| B. | 砹单质是有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的固体 | |
| C. | 硫酸锶难溶于水,但易溶于盐酸 | |
| D. | 砷的最高价氧化物的水化物是一种强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com