
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
| A.0.1s | B.2.5s | C.5s | D.10s |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为25% D.C的体积分数为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在体积不变的密闭容器中,2NO2(g)  N2O4(g) 达到平衡的标志是
N2O4(g) 达到平衡的标志是
①消耗1 mol NO2的同时消耗1 mol N2O4 ②容器内NO2 和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化
| A.①② | B.①②③ | C.③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于判断过程的方向的说法正确的是 ( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
(CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
| A.低温高压 | B.高温低压 | C.低温低压 | D.高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。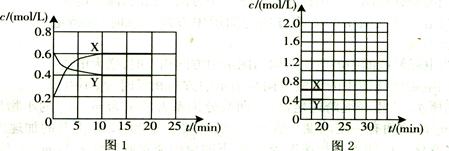
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。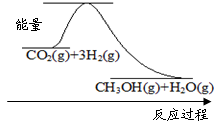
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。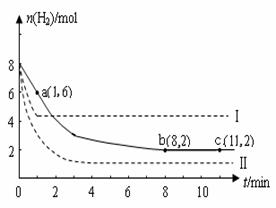
①在反应进行的0~1min内,该反应的平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),反应将向着能够减弱这种改变的方向进行(如增大H2的浓度,反应向右进行以减弱外界条件增大H2的浓度的影响)直至达到新的平衡。若上述反应体系不改变反应物的物质的量,仅分别改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
| A.恒温、恒容条件下,容器内的压强不发生变化 |
| B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定条件下,H2O(g)的浓度保持不变 |
| D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对下列图像的描述正确的是( )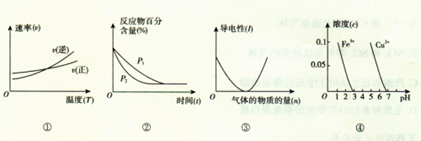
A.根据图①可判断反应A2(g)+3B2(g)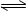 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强(P)对反应2A(g)+2B(g)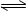 3C(g)+D(s)的影响 3C(g)+D(s)的影响 |
| C.图③可表示向醋酸溶液通人氨气时,溶液导电性随氨气量的变化 |
| D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com