
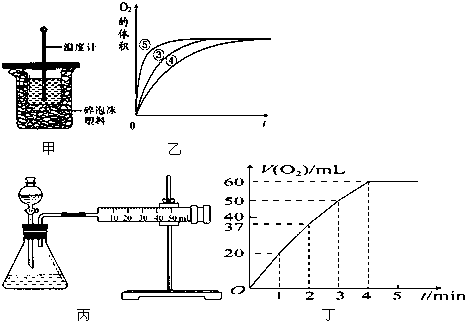
 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ||
| ||
| 0.06 |
| 22.4 |
| 0.00536 |
| 0.05 |
| 0.13g |
| 10s |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| A、2 L 1 mol?L-1的盐酸中所含氯化氢分子数为2NA |
| B、1L 0.1 mol?L-1的NaClO溶液中ClO-数目为0.1NA |
| C、标准状况下,11.2L乙醇完全燃烧生成的CO2分子数为NA |
| D、标准状况下,4.48 L N2所含的共用电子对数0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
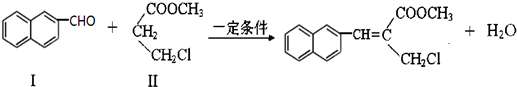
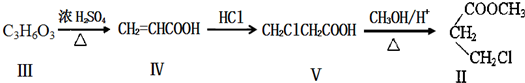
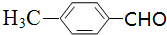 )与1分子化合物(
)与1分子化合物(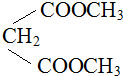 )也能发生Knoevenagel反应,则其生成的有机物的结构简式为
)也能发生Knoevenagel反应,则其生成的有机物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①②③⑤ |
| C、①②③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该装置可能是原电池,也可能是电解池 |
| B、该装置只能是原电池,且电解质溶液为硝酸 |
| C、该装置只能是电解池,且金属银为该电解池的阳极 |
| D、该装置只能是原电池,电解质溶液不可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
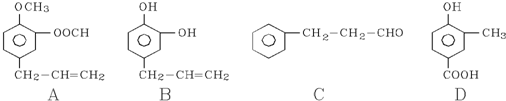
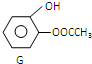
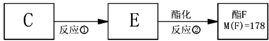
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热盐酸溶液,溶液的pH减小 |
| B、随温度的升高,纯水的pH增大 |
| C、新制氯水经光照一段时间后,pH减小 |
| D、氢氧化钠溶液久置于空气中,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
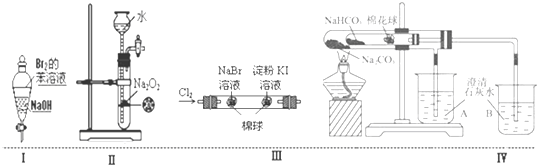
| A、实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B、实验Ⅱ:可随关随停,随开随启控制氧气的发生 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性Cl2>Br2>I2 |
| D、实验Ⅳ:小试管中NaHCO3分解,B中石灰水变浑浊,说明稳定性Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com