
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)根据滴定终点,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,应停止滴定;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)根据滴定管的精确度为0.01mL读数;
(6)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用两次的平均值.
解答 解:(1)欲测定某NaOH溶液的浓度,用标准酸滴定碱,用酚酞作指示剂,开始为红色,滴定终点时,锥形瓶中的溶液从红色变为无色,且半分钟内不褪色,停止滴定,
故答案为:红;无;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化,根据颜色变化,判断滴定终点,
故选:B;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(标准)偏大,
故答案为:待测溶液润洗锥形瓶;偏高;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗,否则,标准液被稀释,
故答案为:据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)滴定管精确到0.01mL,所以滴定管中的液面读数为22.60mL,故答案为:22.60;
(6)V(标准)═$\frac{[(20.40-0.50)+(24.10-4.00)]mL}{2}$=20.00mL,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000mol•L×20.00mL}{25.00mL}$=0.0800mol•L-1,
故答案为:0.0800.
点评 本题主要考查了酸碱中和滴定的操作、误差分析以及有关的化学计算,题目难度中等,掌握中和滴定的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
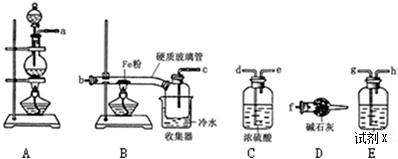
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
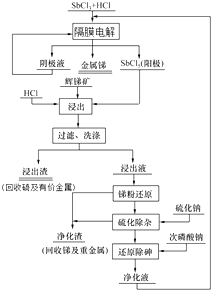
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
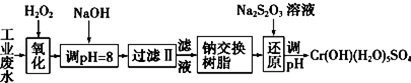
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
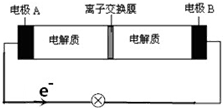 如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )| A. | 充电时,A极应与直流电源正极相连接 | |
| B. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 | |
| C. | 放电时,钠离子从左到右通过离子交换膜 | |
| D. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
. )的合成路线:
)的合成路线: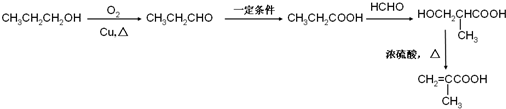 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的中子数为NA | |
| B. | 1molCl2参加氧化还原反应,转移的电子数一定为2NA | |
| C. | T℃时pH=6的纯水中,含有10-6 NA个OH- | |
| D. | 电解精炼铜时,若转移NA个电子,阴极析出32 g铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com