
| A. | 不变 | B. | 由浅绿变棕黄 | C. | 颜色变浅 | D. | 由绿变深绿 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 有机物(g) | 氢气(L) |
| 0.575 | 0.14 |
| 1.15 | 0.28 |
| 2.3 | 0.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数之比1:1 | B. | 密度之比4:11 | C. | 密度之比11:16 | D. | 体积之比11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

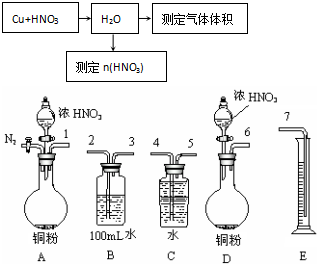
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2+>B2+>A2+>C2+ | B. | A2+>B2+>C2+>D2+ | C. | C2+>A2+>B2+>D2+ | D. | A2+>C2+>D2+>B2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
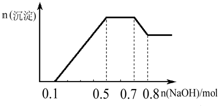
| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式盐的溶液一定显碱性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液是中性的 | |
| C. | 纯水呈中性时因为水中c(H+)=c(OHˉ) | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子物质的量浓度的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com