
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
【答案】C
【解析】试题分析:影响酶促反应速率的因素有:温度、pH、底物浓度和酶浓度等.
分析曲线图:图示表示某种酶在不同处理条件下,催化某反应过程中生成物的量和反应时间的关系,其中a达到化合反应平衡点的时间最短,其次是b,最后是c,说明a条件下酶的活性最高,c条件下酶的活性最低.
解:A、温度能影响酶促反应速率,所以三条曲线的差异可能是由于温度不同造成的,A错误;
B、pH能影响酶促反应速率,所以三条曲线的差异可能是由于pH不同造成的,B错误;
C、反应底物的量不同时,化学反应的平衡点不同,而图中三条曲线的平衡点相同,说明三条曲线的差异不是反应底物的量不同造成的,C正确;
D、酶的浓度能影响酶促反应速率,所以三条曲线的差异可能是由于酶的浓度不同造成的,D错误.
故选:C.


科目:高中化学 来源: 题型:
【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺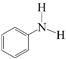 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )

A. X极是电源负极,Y极是电源正极
B. a极的电极反应是2Cl--2e-=Cl2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
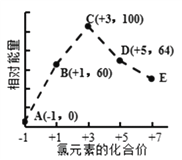
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A. 电池工作时OH-向负极迁移
B. 正极反应式为2Fe![]() +
+![]() =Fe2O3+5H2O
=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变
D. 电子由Zn电极流出,经KOH溶液流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________;向“滤液M”中加入(或通入) ____________(填母代号),可得到另一种流程中可循坏利用的物质。
a.铁 b.氯气 c.高锰酸钾![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是_____。
(2)请写出E反应生成F的化学方程式:_______________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合重要的有机化合物路线如下图所示。请回答下列问题。
![]()
(1)A物质所含官能团的名称是____。
(2)反应③的化学方程式是____。
(3)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
Ⅱ.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是____。
(2)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是____。
②实验开始时,试管b中的导管不伸入液面下的原因是____。
(3)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:__. |
②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为____ mol. |
③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
④写出E与NaHCO3溶液反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com